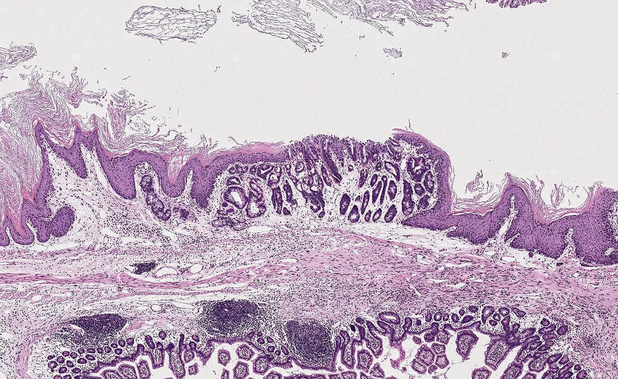
Une équipe de chercheurs de l'ULB a apporté une pierre essentielle à la compréhension du mécanisme qui conduit à la formation de métaplasies sophagiennes et de cancers de l'oesophage.
...
Les cancers de l'oesophage ne sont certes pas les plus fréquents, mais leur incidence est néanmoins de l'ordre de 570 000 cas par an à l'échelle mondiale - un millier en Belgique. Ils sont répartis de façon hétérogène sur la planète, se subdivisant en deux grandes catégories inégalement implantées sur les différents continents: les carcinomes épidermoïdes, qui représentent environ 80% des tumeurs malignes de l'oesophage, et les adénocarcinomes sophagiens. Les premiers touchent essentiellement les pays occidentaux mais surtout l'Asie. En Occident, ils sont largement associés à la consommation d'alcool et de tabac ; en Asie, à celle de boissons chaudes, pour ne pas dire brûlantes. On observe toutefois, tant en Europe qu'aux États-Unis, au Canada et en Australie, une diminution progressive de leur incidence. Elle est attribuée à une réduction du tabagisme. Alors que les carcinomes épidermoïdes "prennent corps" plutôt dans la partie supérieure de l'oesophage, les adénocarcinomes, eux, débutent préférentiellement dans sa partie inférieure, leurs principaux facteurs de risque étant le reflux gastro-sophagien (RGO) chronique et l'obésité. Pourquoi celle-ci? D'abord parce que, pour des raisons mécaniques, le surpoids est un facteur de risque majeur de reflux: l'abdomen, trop large, appuie sur l'estomac et en fait remonter l'acidité dans l'oesophage. "Ensuite, un autre élément, qui concerne tous les types de cancer, est que l'obésité influe sur l'état général des patients. En particulier s'installe, sous l'effet d'une modification du tissu adipeux, une inflammation chronique de caractère systémique qui favoriserait l'apparition des cancers", indique Benjamin Beck, chercheur qualifié du FNRS au sein de l'Institut de recherche interdisciplinaire en biologie humaine et moléculaire (IRIBHM) de l'ULB. Quel que soit le type de cancer de l'oesophage, la survie à 5 ans est inférieure à 20% et, comme le rappelle Benjamin Beck, ne s'est pas améliorée ces deux dernières décennies. L'apport récent de l'immunothérapie est cependant de nature à générer une nouvelle dynamique. Si l'incidence des carcinomes épidermoïdes se réduit en Europe, aux États-Unis, au Canada et en Australie, celle des adénocarcinomes ne cesse d'y croître depuis 40 ans, représentant plus de la moitié des cancers de l'oesophage dans un pays comme le nôtre. Pour quels motifs? L'augmentation de l'obésité dans la population générale? Une autre cause? "Aucune étude n'apporte de réponse formelle à cette question", dit le chercheur de l'IRIBHM. "Les adénocarcinomes de l'oesophage sont proportionnellement plus nombreux en Angleterre qu'en France, en Belgique, aux Pays-Bas ou en Allemagne, par exemple. Or, l'obésité n'est pas spécialement plus importante Outre-Manche. Parmi les facteurs de risque des adénocarcinomes sophagiens - abstraction faite de la dimension génétique - il y a assurément des éléments de l'environnement que l'on cerne encore mal et sur lesquels il n'est donc pas possible de s'appuyer dans une perspective de prévention de la maladie." Les chercheurs de l'IRIBHM étudient les deux types de cancers oesophagiens. Dans un article publié en 2021 dans Cell Stem Cell1, ils ont apporté un éclairage nouveau sur les mécanismes impliqués dans le développement des métaplasies de l'oesophage, lesquelles multiplieraient par 40 le risque de développer un adénocarcinome oesophagien. Depuis les années 1950, le schéma communément admis est celui d'un processus séquentiel au cours duquel un reflux gastro-oesophagien chronique (incidence de 8,8 à 25,9% en Europe) conduit dans certains cas à une modification de l'épithélium de l'oesophage, à une métaplasie: on parle alors d'oesophage de Barrett (OB). Toujours selon ce schéma, une fraction des métaplasies évolue dans un second temps vers la cancérisation. On estime que 10% des individus en proie à du reflux chronique développeront de telles métaplasies et que le taux de progression vers une tumeur maligne est de 0,1% par an. Comme les autres métaplasies, l'oesophage de Barrett associé au RGO est appréhendé comme une modification histologique adaptative à un stress chronique. Son découvreur, le Dr Norman Rupert Barrett, avait émis l'hypothèse que cette lésion précancéreuse pouvait être le fruit d'une tubulisation de l'estomac et de son extension pour coloniser le bas de l'oesophage. "Selon cette hypothèse, la muqueuse de l'estomac migrerait et tapisserait le bas de l'oesophage lorsque celui-ci est exposé chroniquement à de l'acide. Mieux adaptée pour résister à cette agression, elle supplanterait la muqueuse squameuse qui recouvrait initialement l'organe", précise Benjamin Beck. Il souligne dans la foulée que ce scénario a très rapidement été remis en question. En effet, il ne rend pas compte du fait que la "muqueuse de remplacement" est souvent de nature intestinale. Dans la plupart des pays, le diagnostic anatomopathologique d'OB n'est d'ailleurs prononcé qu'en présence d'un épithélium intestinal, occurrence qui, en comparaison de la présence de métaplasies de type transitionnel (cellules non différenciées) ou gastrique, recèle un risque très supérieur d'évolution péjorative vers un adénocarcinome. Les mécanismes mis en oeuvre pour remplacer des cellules squameuses de l'oesophage par des cellules métaplasiques demeuraient méconnus jusqu'il y a peu. À travers leur récente étude publiée dans Cell Stem Cell (premier auteur: Alizée Vercauteren Drubbel), Benjamin Beck et son équipe ont réussi à lever un large coin du voile en décrivant les étapes du processus de transition. Ils ont pour cela noué une collaboration avec une chirurgienne spécialiste de l'étude du RGO et des métaplasies, la Pr Sachiyo Nomura, de la Tokyo Medical University. La question cardinale abordée dans ces travaux était: comment une cellule de l'oesophage peut-elle être reprogrammée et changer d'identité? Les chercheurs ont eu recours à des souris qu'ils ont soumises à un reflux chronique sévère. Ils observèrent qu'en réponse à ce dernier, la voie de signalisation Hedgehog, éteinte depuis l'embryogenèse, se réactivait dans l'oesophage. Cette réactivation apparut comme un élément déclencheur pour l'induction d'une dédifférenciation des kératinocytes, menant ainsi à la formation d'un épithélium semblable à celui d'un oesophage embryonnaire. Ensuite se produisait chez une minorité de cellules dédifférenciées (environ 10%) une différenciation non plus vers des cellules squameuses typiques de l'épithélium sophagien, mais vers des cellules qui exprimaient des marqueurs de cellules intestinales. "Dans notre modèle murin, les souris ne présentaient pas vraiment de lésions spécifiques de l'OB, mais un changement phénotypique de nature essentiellement transcriptomique: beaucoup de marqueurs exprimés au niveau des ARN étaient en lien avec l'intestin", tient à faire remarquer Benjamin Beck. Selon le chercheur, l'activation seule de la voie Hedgehog est probablement le premier élément qui induit les changements d'identité des kératinocytes. Mais parmi ceux-ci, seule une faible fraction (nous avons cité le chiffre de quelque 10%) pourra former une métaplasie, un épithélium évoquant la muqueuse intestinale. La question est alors: comment un kératinocyte dédifférencié peut-il emprunter un nouveau chemin de différenciation? Benjamin Beck et ses collaborateurs ont mis en évidence que cela nécessitait, pour les cellules dédifférenciées, la capacité d'acquérir la protéine Sox9. "En bloquant expérimentalement l'expression de ce facteur de transcription, nous avons totalement annihilé l'apparition de cellules métaplasiques". L'incapacité d'une majorité de cellules dédifférenciées à mobiliser Sox9 expliquerait pourquoi la plupart des individus souffrant de RGO chronique ne font pas de métaplasies ni de cancers de l'oesophage. Dans une recherche en cours, l'équipe de l'IRIBHM semble avoir découvert comment l'expression de Sox9 est modulée. Le processus impliqué serait indépendant de la réactivation de la voie de signalisation Hedgehog elle-même. L'expression du facteur de transcription serait induite via la stimulation des cellules dédifférenciées par des cellules inflammatoires, lesquelles, par ailleurs, ne seraient pas à même de stimuler des cellules différenciées. En résumé, le reflux chronique provoquerait le "réveil" de la voie de signalisation Hedgehog, qui serait le moteur de la transformation des kératinocytes en cellules dédifférenciées ; la présence de cellules inflammatoires stimulerait l'expression de Sox9 dans lesdites cellules dédifférenciées avec, pour résultat, leur différenciation, dans le modèle murin, en cellules semblables à celle de la muqueuse intestinale et, chez l'homme, probablement en cellules évoquant tantôt la muqueuse de l'estomac, tantôt la muqueuse de l'intestin. Reste qu'on ne sait toujours pas pourquoi une métaplasie, et plus particulièrement une métaplasie de type intestinal, serait susceptible d'engendrer un adénocarcinome sophagien. Pour quelle raison les kératinocytes devraient-ils changer de statut afin d'y parvenir? Cette question est au centre d'un projet initié par Benjamin Beck et son équipe. Réalisée chez l'humain et publiée en août 2021 dans Science2 par le groupe de Rebecca Fitzgerald (Université de Cambridge, Angleterre), une étude in silico semble cependant montrer que ces cancers n'émaneraient pas des cellules métaplasiques hautement différenciées mais des cellules dédifférenciées. "Les pools de cellules dédifférenciées générées par la réactivation de la voie Hedgehog pourraient donc constituer un réservoir pour les cancers", suggère Benjamin Beck. Néanmoins, la corrélation établie depuis les années 1950 entre métaplasies et cancers existe bel et bien. Dès lors, ne faut-il pas en déduire que les métaplasies intestinales et les cancers de l'oesophage ne seraient pas liés par une relation de cause à effet mais auraient plutôt une origine commune, le reflux chronique, qui serait en soi carcinogène. "Cette idée demeure hypothétique au stade actuel", insiste Benjamin Beck. "Les métaplasies sont un risque majeur pour les adénocarcinomes de l'oesophage mais il n'est pas impossible que de telles tumeurs apparaissent en l'absence d'une métaplasie préalable. L'importante proportion de patients présentant des métaplasies sans développer de cancer est un argument en faveur de l'hypothèse que la différenciation des cellules de l'épithélium sophagien en cellules intestinales ne serait pas un élément causal dans l'apparition des tumeurs." Malgré tout - et cela est à terme un des objectifs des chercheurs de l'IRIBHM - il paraît primordial d'identifier des marqueurs pouvant déterminer, parmi les patients avec métaplasie, ceux chez qui un processus de cancérisation est à redouter. "Les patients à risque pourraient être suivis de façon plus rapprochée et l'on pourrait envisager pour eux une méthode telle que la dissection sous-muqueuse afin d'enlever les zones de l'oesophage risquant de progresser vers un cancer. À l'inverse, en l'absence de marqueurs, les patients bénéficieraient d'un suivi plus espacé. Compte tenu de la fréquence de métaplasies de l'oesophage et du coût du suivi, disposer de marqueurs pourrait avoir un impact sociétal substantiel", conclut Benjamin Beck.