Lors de ce symposium virtuel du 8 octobre, un aperçu global du traitement optimal, actuel et futur, des patients atteints d'un myélome, tout au long de leur maladie, a été donné, au sens figuré et littéral.
...
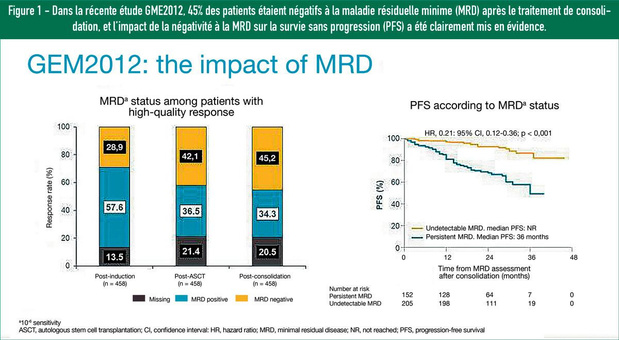
Le Pr Michel Delforge (UZ Leuven, président du Leuvens Kankerinstituut), modérateur du symposium, était présent en studio aux côtés de la Pr Nathalie Meuleman (Institut Bordet, Bruxelles), de la Dr Ann Van De Velde (Universitair Ziekenhuis Antwerpen) et de la Pr Marie-Christiane Vekemans (UCL Saint-Luc, Bruxelles). Le point de vue américain a été exposé en direct depuis les États-Unis par l'un des grands experts internationaux dans le domaine du myélome, le Pr Paul Richardson ( Director of clinical research, Dana Farber Cancer Institute, Boston, MA). Le symposium était le fruit d'une collaboration entre Bristol Myers Squibb et la Belgian Hematology Society. En voici quelques thèmes. Selon le Pr Delforge, le traitement de 1re intention est essentiel pour la suite de l'évolution de la maladie et, à cet égard, il ne faut pas perdre de vue l'objectif visé pour chaque patient individuel. En principe, l'éradication totale de la maladie est visé, mais chez certains patients, le plus important est de trouver un bon équilibre entre la qualité de vie et le contrôle de la maladie. Les trithérapies bien connues, comme les associations bortézomib-thalidomide-dexaméthasone (VTd) et bortézomib-cyclophosphamide-dexaméthasone (VCd), continuent de jouer un rôle majeur lors du traitement d'induction. Les directives de l'ESMO1 mentionnent également l'association lénalidomide-bortézomib-dexaméthasone (RVd) (pas encore disponible en Belgique dans ce contexte). Dans la récente étude GME2012, 45% des patients étaient négatifs à la maladie résiduelle minime (MRD) après le traitement de consolidation, et l'impact de la négativité à la MRD sur la survie sans progression (PFS) a été clairement mis en évidence. 2 Le Pr Richardson a également abordé les résultats de l'étude GRIFFIN, sur les conséquences de l'ajout de daratumumab au traitement d'induction et de consolidation par RVd ainsi qu'au traitement d'entretien par lénalidomide.3 Le nombre de patients négatifs à la MRD était plus de deux fois supérieur dans le groupe recevant la combinaison daratumumab-RVd (D-RVd), par rapport au bras RVd (68,8% contre 32,3% au moment de la dernière analyse). Les résultats dans les deux bras sont très bons jusqu'à présent en termes de PFS et de survie globale (OS). Lorsque les données seront plus matures, il sera possible d'évaluer s'il existe une différence entre les deux bras. À l'avenir, la quadrithérapie devrait devenir la norme pour le traitement d'induction, estime le Pr Richardson. Pour le traitement d'entretien, le lénalidomide reste la norme, mais nous assisterons peut-être à une évolution vers un traitement combiné si des études montrent sa supériorité. Par ailleurs, il est intéressant de se demander si le traitement peut être arrêté lorsque le patient est négatif à la MRD. L'essai MASTER en cours, où le traitement est interrompu deux cycles après l'obtention de la négativité à la MRD, permettra d'en savoir plus. 4 Pour le traitement de 1re intention des patients qui ne sont pas candidats à une greffe de cellules souches autologue (GCSA), il est extrêmement important de trouver un équilibre entre efficacité et toxicité. Les directives actuelles de l'ESMO recommandent des options telles que l'association bortézomib- melfalan-prednisone (VMP), le Rd et le RVd (1), les deux premières permettant d'atteindre une OS d'environ 60 mois. 5,6 Dans l'étude SWOG S0777, qui comparait le RVd et le Rd, un avantage net de PFS a été observé pour le RVd (41 mois vs 29 mois), dans toutes les catégories d'âge. L'OS médiane n'était pas encore atteinte dans le groupe RVd (69 mois dans le groupe Rd) après un suivi médian de sept ans. 7,8 Selon le Pr Richardson, pour les patients plus fragiles, un régime " RVd lite ", donnant lieu à une toxicité moindre (neuropathie, notamment), est souvent utilisé dans la pratique. 9 La casuistique présentée ensuite par la Pr Meuleman et la Dr Van De Velde a clairement montré qu'il était également très important, pour les patients dits fragiles, d'évaluer dans quelle mesure cette fragilité est causée par la maladie ou préexistait. Si elle est liée à la maladie, il y a de bonnes chances que le patient puisse bien supporter un traitement (éventuellement selon un schéma thérapeutique adapté) et devienne ainsi rapidement moins fragile. Dans ce contexte également, les bons résultats déjà été observés lors de l'ajout d'un traitement ciblant CD38, dans lequel le daratumumab avait été ajouté à l'association VMP10 ou Rd11, devraient se poursuivre. Enfin, il sera intéressant de voir si la greffe upfront demeurera toujours nécessaire, maintenant que la négativité de longue durée à la MRD devient un objectif de plus en plus réalisable. Le Pr Richardson a indiqué que l'essai DETERMINATION n'avait pas encore fourni de conclusions car les deux groupes obtenaient de très bons résultats. Nous en saurons probablement plus dans le courant de l'année prochaine! Nous retenons également un certain nombre de points importants des présentations de la Pr Vekemans et du Pr Richardson, ainsi que du cas présenté par la Pr Meulemans et la Dr Van De Velde. Dans ce cas aussi, il est important de bien définir l'objectif du traitement, en concertation avec le patient, cela va de soi. D'autres facteurs jouent un rôle dans le choix du traitement en cas de récidive, à savoir: ? le ou les traitements antérieurs, la réponse à ceux-ci et la toxicité (résiduelle) ; ? la cytogénétique ; ? l'âge et les comorbidités ; ? les préférences du patient (forme d'administration, par exemple). Dans les directives de l'ESMO, les choix liés à un traitement de 2e intention sont en grande partie déterminés par le traitement de 1re intention, soit à base d'un IMiD, soit à base d'un PI1. Les bithérapies (Vd, Kd, Rd) deviennent alors des trithérapies incluant un traitement ciblant CD38, telles que le DRd et le DVd. Les études POLLUX et CASTOR, respectivement, ont mis en évidence un avantage important de PFS pour ces combinaisons et la négativité à la MRD. 12,13 L'association carfilzomib-lénalidomide-dexaméthasone (KRd) est également une option en 2e intention ou plus tard (1). Pour la population réfractaire au lénalidomide, il existe désormais une possibilité supplémentaire importante de traitement par pomalidomide-bortézomib-dexaméthasone (PVd), comme l'a montré l'étude OPTIMISMM comparant le PVd et le Vd. Un avantage en termes de PFS de 11,2 mois a été observé, contre 7,1 mois (HR 0,61). 14,15 Par ailleurs, de nombreux nouveaux traitements sont en cours de développement, à la fois des anticorps anti-CD38 et des thérapies cellulaires telles que les CAR-T, dont nous entendrons très certainement encore beaucoup parler dans un avenir proche.