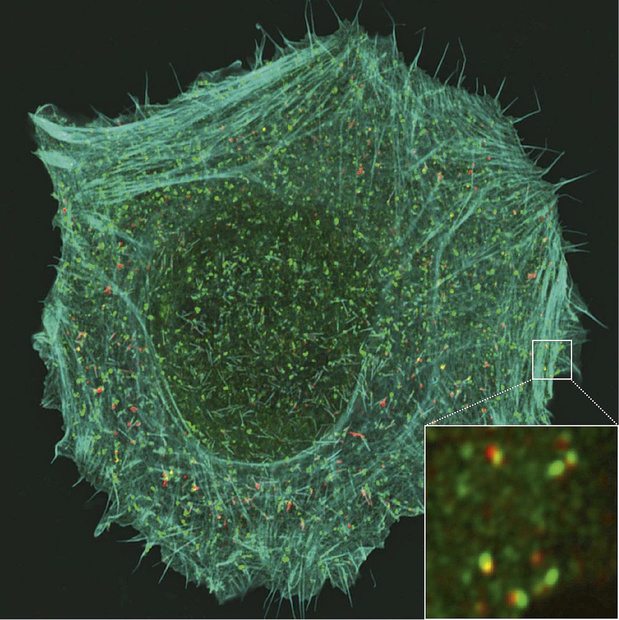
Selon des travaux réalisés à l'UCLouvain, certaines cellules cancéreuses pourraient recourir à une voie d'endocytose inédite impliquant la protéine membranaire CD166 pour migrer et former des foyers métastatiques.
...
A u sein du Louvain Institute of Biomolecular Science Technology (LIBST), le laboratoire de biologie des membranes dirigé par le Pr Pierre Morsomme mène depuis quelques années des recherches relatives au rôle et à la localisation des protéines membranaires. Les membranes biologiques qui séparent les milieux intracellulaire et extracellulaire ne constituent pas des frontières totalement imperméables. Comment les cellules contrôlent-elles l'internalisation d'éléments en provenance de l'extérieur? Pour réaliser de telles études, les chercheurs recourent principalement à la levure Saccharomyces cerevisiae (levure de bière) et à des cellules humaines en culture. "Parmi les mécanismes que nous étudions, l'un d'eux a retenu particulièrement notre attention: l'endocytose", rapporte le Pr Morsomme. Des composants de la membrane plasmique comme des lipides ou des protéines membranaires, mais également des éléments extérieurs à la cellule comme des toxines ou des virus, peuvent pénétrer dans le milieu intracellulaire par cette voie. Une petite vésicule, formée à partir de la membrane plasmique, va englober les éléments pour les "déposer" dans la cellule. "À ce moment, deux événements peuvent se produire: soit les protéines membranaires (notre centre d'intérêt) sont dirigées vers les lysosomes, où elles sont dégradées, soit elles sont provisoirement stockées dans la cellule avant d'être recyclées, c'est-à-dire renvoyées à la surface de la membrane plasmique pour y remplir une fonction", précise Pierre Morsomme. Le mécanisme d'endocytose qui dépend de la clathrine est très étudié depuis quelques décennies et très bien caractérisé. D'ailleurs, on a longtemps cru qu'il représentait la seule porte d'entrée de la cellule par endocytose. Comme le rappelle le chercheur, la clathrine est une protéine dont la structure suggère un cintre pourvu non de deux, mais de trois branches. Elle peut s'oligomériser. L'association de plusieurs molécules de clathrine les unes avec les autres forme une sorte de cage qui exerce une contrainte physique sur la membrane plasmique, l'obligeant à se déformer et à donner naissance à une vésicule d'endocytose. Aujourd'hui, plusieurs processus endocytaires indépendants de la clathrine ont été décrits, mais leur intervention dans des contextes physiopathologiques tels que le cancer demeure nimbée d'un profond mystère. Une intense activité de recherche à laquelle le laboratoire du LIBST participe assidûment est axée sur l'identification et la caractérisation de "nouvelles voies" d'endocytose. C'est dans ce cadre que le laboratoire a découvert, grâce à une technique de criblage protéomique basée sur la spectrométrie de masse, une voie inédite susceptible d'avoir des retombées en oncologie et, plus particulièrement, dans le domaine de la cascade métastatique. Ces travaux ont fait l'objet d'un article dans Nature Communications en 20201 dont les premiers auteurs en étaient Henri-François Renard, aujourd'hui professeur à l'UNamur, et François Tyckaert, chercheur au LIBST. Pierre Morsomme précise la procédure suivie par son équipe: "Nous avons inhibé la clathrine dans certaines cellules et, par comparaison avec des cellules normales, nous avons observé, au niveau du protéome de la membrane plasmique, quelles protéines étaient internalisées malgré son absence. Nous avons trouvé ainsi une nouvelle modalité d'endocytose non encore caractérisée jusque-là et perçu que, parmi les protéines passant de l'extérieur vers l'intérieur de la cellule, l'une d'elles, CD166, était particulièrement intéressante." En l'absence de clathrine, les chercheurs de l'UCLouvain ont voulu identifier les protéines requises pour permettre à CD166 de pénétrer dans les cellules. Ils ont mis le doigt sur l'endophiline-A3, de la famille des protéines à domaine BAR. Celles-ci ont la forme d'un croissant et sont potentiellement capables d'induire une courbure au niveau des membranes cellulaires et, partant, d'initier un phénomène d'endocytose. Plusieurs laboratoires avaient déjà montré qu'une autre protéine à domaine BAR, l'endophiline-A2, pouvait être impliquée dans l'endocytose, notamment pour le passage de la toxine de Shiga dans le milieu intracellulaire. La voie régulée par l'endophiline-A3 pour l'entrée de CD166 dans la cellule n'avait cependant jamais été identifiée. De surcroît, les biologistes ont constaté que, dans le processus d'endocytose, l'endophiline-A3, protéine intracellulaire, était épaulée par une protéine extracellulaire: la protéine galectine-8. "Hormis CD166, l'endophiline-A3 et galectine-8, beaucoup d'autres protéines concourant à cette voie restent à découvrir. Mon équipe est en train d'essayer de la baliser, en collaboration avec Henri-François Renard à l'UNamur, le laboratoire de Pierre van der Bruggen, à l'UCLouvain, et l'Institut Curie à Paris", indique le Pr Morsomme. La protéine CD166 n'est pas inconnue: il est établi qu'elle est surexprimée dans certains cancers - sein, poumon, pancréas, tumeurs colorectales, mélanome - pour lesquels elle est par ailleurs un des biomarqueurs. On sait également qu'il existe une corrélation entre son niveau d'expression dans ces cancers et le pronostic du patient. Toutefois, les mécanismes de régulation de la protéine n'avaient jamais été explorés jusqu'à l'étude entreprise à Louvain. Et c'est précisément à travers ces mécanismes intimes que d'intéressantes hypothèses sur l'implication de CD166 dans la cascade métastatique et sur les interactions entre les cellules cancéreuses et le système immunitaire ont pu être formulées. En s'appuyant sur des méthodes de microscopie de pointe (TIRFM et lattice light sheet) mises en oeuvre à l'Institut Curie, les biologistes du LIBST ont pu étudier CD166, une protéine membranaire d'adhésion dont le ligand peut être une protéine CD166 ou une protéine CD6 localisées sur une autre cellule.Selon la terminologie imagée des chercheurs, CD166 joue le rôle de "velcro" afin de permettre aux cellules constitutives d'une même structure de rester solidaires. Les cellules cancéreuses ne dérogent pas à la règle - se multipliant et s'agglutinant sur le site de la tumeur primaire - si ce n'est quand certaines d'entre elles migrent pour aller former des foyers métastatiques. Or, qu'ont observé les chercheurs du LIBST en s'intéressant à des cellules cancéreuses en culture, notamment des cellules de la lignée "immortelle" HeLa? Que des cellules malignes où le nombre de protéines CD166 présentes à la surface de leur membrane plasmique a été diminué artificiellement, soit par réduction de l'expression du gène codant pour CD166, soit par augmentation de l'endocytose via la surexpression de l'endophiline-A3, voient faiblir leur force d'adhésion les unes aux autres. "Lorsque CD166 est présente, les cellules tumorales adhèrent plus et migrent moins et lorsque CD166 est peu abondante ou absente, c'est l'inverse", résume le Pr Morsomme. D'où l'idée que certaines cellules cancéreuses seraient capables d'induire une diminution de l'abondance de CD166 à leur surface par endocytose et, rendues plus "libres de leurs mouvements", se détacheraient et essaimeraient. "Néanmoins, nous nous sommes limités à des modèles cellulaires et, actuellement, n'avons pas de données relatives au comportement des cellules cancéreuses au niveau d'une tumeur", commente le responsable du laboratoire. Pour savoir si la voie endocytaire ayant trait à CD166 est réellement impliquée dans la cascade métastatique, des études portant sur des modèles plus complexes sont indispensables. "Ces recherches pourraient faire appel à des organoïdes ou à des modèles in vivo physiologiquement pertinents, ce qui dépasse les compétences de notre laboratoire. Des collaborations devraient s'établir." En théorie - pure spéculation! - on peut imaginer qu'inhiber l'endocytose permettrait de conserver une quantité abondante de CD166 à la surface des cellules cancéreuses et, par là même, d'éviter leur migration et la formation de métastases. Mais on ne dispose actuellement d'aucun inhibiteur de l'endocytose dépendante de l'endophiline-A3. D'autre part, on sait que l'abondance de CD166 est corrélée avec le développement de certaines tumeurs. "Autrement dit, la surexpression de CD166 serait de nature à favoriser le développement tumoral et sa sous-expression, celui de métastases. Toute thérapie fondée sur cette voie devrait reposer sur un équilibre très subtil. Aussi, dans l'état actuel des connaissances, est-il prématuré de chercher une thérapie qui ciblerait spécifiquement CD166, d'autant que cette protéine joue un rôle physiologique au niveau des cellules normales." Comme il existe diverses autres protéines d'adhésion, le chercheur estime qu'un préalable serait d'étudier comment elles sont endocytées et régulées afin de dégager un panorama complet de la manière dont les cellules tumorales adhèrent les unes aux autres. "Ce serait un premier pas vers une approche thérapeutique", ajoute-t-il. Parallèlement, les biologistes du LIBST pensent que CD166 pourrait jouer un rôle dans la formation des synapses immunes, en l'occurrence les interfaces de connexion entre cellules cancéreuses et cellules du système immunitaire, en particulier les lymphocytes T CD8. Le groupe de l'UCLouvain a entrepris des recherches pour appréhender cette question. L'hypothèse est que les cellules cancéreuses concentreraient des molécules de CD166 à l'endroit où elles se connectent avec d'autres cellules, afin de renforcer leur cohésion avec d'autres cellules malignes et ainsi favoriser le développement tumoral local. "Les protéines CD166 présentes ailleurs sur la membrane plasmique seraient internalisées par endocytose et redirigées vers le point de contact, explique Pierre Morsomme. Si ce processus est bénéfique pour le développement tumoral lorsque ce sont des cellules cancéreuses qui s'unissent, il n'en serait rien si la cellule rencontrée est un lymphocyte T CD8, par exemple. En d'autres termes, le système immunitaire pourrait utiliser CD166 comme une arme contre la tumeur." Dans ce cas, CD166 pourrait éventuellement être exploitée à terme, selon des modalités à définir, dans le cadre de l'immunothérapie du cancer. Le Pr Morsomme précise néanmoins que cette hypothèse reste très spéculative.