Le cancer du sein triple négatif est associé à un pronostic particulièrement défavorable comparé aux autres types de cancer du sein. Les résultats positifs rapportés cette année dans le cadre de l'étude KEYNOTE-355 évaluant le pembrolizumab, ainsi que par l'étude IMpassion130 évaluant l'atézolizumab, ont attiré l'attention sur l'impact favorable de l'immunothérapie dans ce groupe de patientes.
...
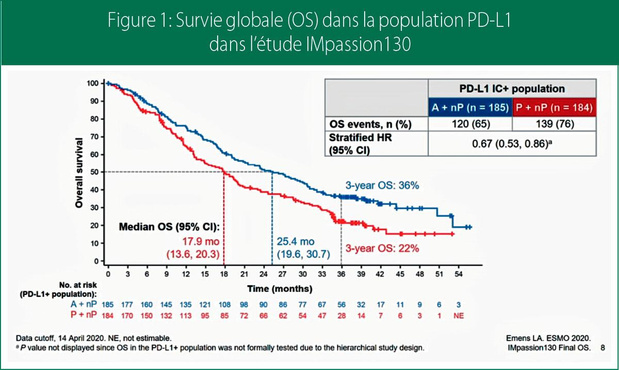
Sur base des résultats de l'étude IMpassion130, les recommandations internationales préconisent désormais l'association atézolizumab + nab-paclitaxel pour les patientes atteintes d'un cancer du sein triple négatif (TNBC) localement avancé ou métastatique exprimant le PD-L1. Lors de ce congrès virtuel de l'ESMO 2020, le Dr Leisha Emens (Hillman Cancer Center, Pittsburgh) a présenté l'analyse définitive de la survie globale (OS) de l'étude IMpassion130, qui a randomisé 902 patientes présentant un TNBC métastatique ou localement avancé pour recevoir l'association atézolizumab + nab-paclitaxel ou l'association placebo + nab-paclitaxel. Dans la population totale, un bénéfice numérique, mais non significatif, a été observé pour le groupe traité par nab-paclitaxel + atézolizumab (21,0 contre 18,7 mois ; HR 0,87 ; p=0,077). Une sous-analyse a toutefois démontré un allongement cliniquement important de l'OS (7,5 mois) avec l'association atézolizumab + nab-paclitaxel par rapport à l'association nab-paclitaxel + placebo chez les patientes dont la tumeur exprime le PD-L1 (25,4 contre 17,9 mois ; HR, 0,67). (Fig. 1). Il est important de noter que l'OS à 3 ans s'élevait à 36% dans la population PD-L1 traitée par atézolizumab + nab-paclitaxel, contre 22% dans le groupe placebo + nab- paclitaxel, ce qui démontre le bénéfice prolongé conféré par l'atézolizumab chez les patientes souffrant d'un TNBC. Inversement, aucun signe d'efficacité n'a été relevé chez les patientes PD-L1-négatives (1). Selon le Pr David Miles (Mount Vernon Cancer Centre, Northwood), qui a présenté les résultats de l'étude similaire IMpassion131, ceux-ci confirment les données de l'étude Impassion130. L'étude IMpassion 131 a randomisé, selon un schéma 2: 1, des patientes présentant un TNBC métastatique ou localement avancé et inopérable pour recevoir atézolizumab 840 mg aux jours 1 et 15, plus paclitaxel 90 mg/m2 aux jours 1, 8 et 15, tous deux selon un schéma de 28 jours, ou pour recevoir le paclitaxel selon un même schéma + placebo. L'objectif principal était la survie sans progression (PFS). Les résultats, présentés lors de l'ESMO 2020, étaient à la fois décevants et inattendus. La PFS ne différait pas de façon significative entre l'association atézolizumab + paclitaxel et placebo + paclitaxel, tant dans la population PD-L1-positive (6,0 contre 5,7 mois ; HR 0,82 ; p=0.20) que dans la population en intention de traiter (ITT) (5,7 contre 5,6 mois ; HR 0,86). (Fig. 2) Une première analyse intermédiaire de l'OS, avec des décès survenus chez seulement 27% de la population ITT, a montré une différence numérique plutôt au détriment de l'association atézolizumab + paclitaxel. Une mise à jour prenant en compte des décès chez 47% de la population ITT a quelque peu atténué cet effet négatif sur la survie. La survie médiane dans le groupe PD-L1-positif est de 22,1 mois pour l'association atézolizumab + paclitaxel, contre 28,3 mois pour le groupe comparatif composé du paclitaxel seul. Un résultat comparable a été obtenu dans la population ITT (19,2 contre 22,8 mois). Le profil de sécurité des deux bras était compatible avec les données déjà obtenues dans le cadre d'autres études évaluant ces schémas. Dès lors, le Pr Miles conclut qu'il convient d'explorer plus en détail la raison de la différence constatée par rapport au bénéfice observé dans l'étude IMpassion130 (atézo + nab-paclitaxel) (2). Une dernière étude évaluant l'atézolizumab est l'étude IMpassion 031, étude néo-adjuvante menée auprès de patientes atteintes d'un TNBC, présentée par le Pr Nadia Harbeck (Ludwig Maximilians University Hospital, Munich). Cette étude internationale, randomisée et en double aveugle a examiné l'effet de l'ajout de l'atézolizumab à une chimiothérapie préopératoire classique. Les patientes ont reçu durant 12 semaines un traitement 2 fois/mois par nab-paclitaxel, suivi de 4 cycles de chimiothérapie combinée à base de doxorubicine/cyclophosphamide. Les patientes ont été randomisées pour recevoir ou non l'atézolizumab en plus de ce traitement. Lorsque les patientes du groupe atézolizumab présentaient une réponse pathologique complète à la chirurgie, elles ont reçu 11 doses supplémentaires d'atézolizumab. Au total, 333 patientes ont été randomisées et 307 étaient disponibles pour une première analyse. La rémission pathologique complète, soit l'un des critères d'évaluation principaux de l'étude, a montré une différence absolue de 16,5% en faveur des patientes pour lesquelles l'atézolizumab avait été ajouté à leur traitement dans la population ITT (57,6% vs 41,1% ; p = 0.0044). Une répartition selon le statut PD-L1 a mis en évidence un schéma quasi identique, avec une rémission chaque fois plus élevée et plus complète pour le groupe traité par atézolizumab que pour celui traité par placebo, donc à la fois pour le groupe PD-L1 positif (différence absolue 19,5%) que pour le groupe PD-L1- négatif (différence absolue 13,3%). Des données réellement impressionnantes, et il est en outre intéressant de constater que le bénéfice en faveur de l'atézolizumab était indépendant du statut PD-L1. Ceci contraste fortement avec les données décrites ci-dessus dans la maladie métastatique, où le bénéfice de l'atézolizumab est réellement limité aux patientes PD-L1-positives. Les résultats concordent cependant avec les données de l'étude KEYNOTE-522, dans laquelle le pembrolizumab avait été ajouté à une chimiothérapie composée d'une anthracycline, d'une taxane et de platine. Cette étude a elle aussi mis en évidence, indépendamment du statut PD-L1, une amélioration statistiquement significative de la rémission pathologique complète dans le bras ayant reçu le pembrolizumab en sus (3). Enfin, dans cette population de patientes atteintes d'un cancer du sein triple négatif métastatique, mentionnons encore l'étude ASCENT de phase III, présentée par le Dr Bardia (Harvard Medical School, Boston). Cette étude internationale de phase III, ouverte et randomisée, a comparé le sacituzumab govitécan (10 mg/kg IV) à une chimiothérapie en monothérapie sélectionnée par le médecin traitant parmi la capécitabine, l'éribuline, la vinorelbine ou la gemcitabine ; l'étude a été menée auprès de 468 patientes présentant un TNBC récidivant ou réfractaire, négatif pour les métastases cérébrales, qui avaient reçu au moins deux chimiothérapies (dont une taxane) pour la maladie métastatique. Le sacituzumab govitécan consiste en un anticorps anti-Trop-2 couplé au SN-38, le métabolite actif de l'irinotécan. La PFS médiane, critère d'évaluation principal, était considérablement plus longue avec le sacituzumab govitécan qu'avec la chimiothérapie en monothérapie (5,6 mois contre 1,7 mois ; [HR] 0,41 ; p<0.0001). L'OS médiane s'élevait à 12,1 mois avec le sacituzumab govitécan vs 6,7 mois pour le groupe avec chimiothérapie en monothérapie (HR 0,48 ; p<0.0001). (Fig. 3) Les pourcentages de réponse objectifs étaient respectivement de 35% et 5% (p<0,0001). Le sacituzumab govitécan était un traitement sûr, associé à des effets indésirables bien gérables (4).1. L.A. Emens et al, IMpassion130: Final OS analysis from the pivotal phase III study of atezolizumab + nab-paclitaxel vs placebo +nab-paclitaxel in previously untreated locally advanced or metastatic triple-negative breast cancer, ESMO 2020, Presentation ID LBA16 2. D.W. Miles et al, Primary results from IMpassion131, a double-blind placebo-controlled randomised phase III trial of first-line paclitaxel (PAC) ± atezolizumab (atezo) for unresectable locally advanced/metastatic triple-negative breast cancer (mTNBC), ESMO 2020, Presentation ID LBA15 3. A. Bardia et al. ASCENT: A randomized phase III study of sacituzumab govitecan (SG) vs treatment of physician's choice (TPC) in patients (pts) with previously treated metastatic triple-negative breast cancer (mTNBC), ESMO 2020, Presentation ID LBA17 4. N. Harbeck et al. IMpassion031: Results from a phase III study of neoadjuvant (neoadj) atezolizumab + chemotherapy in early triple-negative breast cancer (TNBC), ESMO 2020, Presentation ID LBA11