Divers aspects immunologiques du carcinome du côlon (CCR) ont été abordés lors de l'Education Weekend de l'ESMO. L'utilisation de l'Immunoscore lors du pronostic et celle de biomarqueurs afin de prédire la réponse à l'immunothérapie, en particulier, ont été approfondies.
...
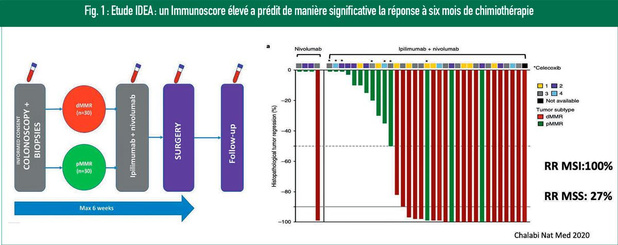
Le Dr Jerôme Galon, chef du laboratoire d'immunologie et cancérologie intégratives de l'INSERM (Paris), a discuté de la valeur de l'Immunoscore, un test in vitro qui peut être employé lors du diagnostic du CCR. Lors de ce test, l'infiltration du centre et des marges de la tumeur par des lymphocytes T CD8+ et CD3+ est mesurée de manière quantitative et exprimée par un score allant de I0 à I4. L'utilisation de l'Immunoscore a été normalisée et validée par un consortium international, chez plus de 2500 patients atteints d'un CCR de stade I-III, selon la classification TNM1. Cette étude a montré que les patients qui possédaient l'Immunoscore le plus élevé présentaient le risque le plus faible de récidive de la tumeur, la plus longue survie globale (OS) et la plus longue survie sans maladie (DFS). Le consensus Immunoscore a également pu prédire le risque de récidive avec une valeur pronostique indépendante et supérieure au système de classification TNM traditionnel pour le CCR de stade I-III. L'évaluation du CCR de stade III lors de l'étude clinique française du consortium IDEA a montré que l'Immunoscore possédait également une valeur prédictive2. Dans cette étude, des patients ont reçu un traitement adjuvant de 3 ou 6 mois par FOLFOX ; un Immunoscore élevé a prédit de manière significative la réponse à six mois de chimiothérapie2,3. En outre, il est également apparu que l'Immunoscore prédisait la réponse chez les patients à faible risque (T1-3 et N1) et à haut risque (T4 ou N2). Chez les patients atteints d'un CCR de stade III, l'Immunoscore a également pu être utilisé pour identifier les patients à haut risque4. Un Immunoscore élevé semblait être associé de manière significative à une OS plus longue. Les données suggèrent, en outre, que les patients possédant un Immunoscore plus élevé retirent le plus grand bénéfice de la chimiothérapie. Dans la dernière édition de la classification OMS des tumeurs du système digestif, la réponse immunitaire a été introduite comme critère diagnostique essentiel et souhaitable pour le cancer colorectal ; l'Immunoscore est cité comme meilleure preuve clinique en cas de CCR5. En 2020, les Clinical Practice Guidelines de l'ESMO relatives au carcinome localisé du côlon ont également inclus l'Immunoscore afin d'affiner le pronostic et d'ajuster le processus décisionnel concernant la chimiothérapie chez les patients à faible risque de stade II, mais aussi de stade III6. Selon le Dr Galon, la prochaine étape est l'implémentation de l'Immunoscore dans la pratique clinique et son introduction dans un système de classification TNM immunitaire (TNMI) par l'AJCC/UICC. Le Dr Guillaume Argilés, du Memorial Sloan Kettering Cancer Center, à New York, a donné un aperçu des marqueurs génétiques utiles pour sélectionner le traitement le plus adéquat. L'immunothérapie ciblant le PD-1 est aujourd'hui une option pour les patients atteints d'un CCRm MSI-H/MMRd (seulement 5% des patients). Diverses études cliniques ont désormais prouvé l'activité clinique du traitement anti-PD1 chez les patients atteints d'un CCRm MSI-H. Le pembrolizumab a entre-temps été reconnu, sur base des résultats de l'étude KEYNOTE-177, comme traitement standard de 1re intention pour le CCRm MSI-H6. Dans cette étude, le groupe pembrolizumab comportait toutefois aussi un groupe de patients avec une progression rapide. Il est donc important de trouver des biomarqueurs permettant de comprendre pourquoi une partie des tumeurs MSI-H échappe à l'immunothérapie. Sur base de l'étude KEYNOTE-158, la FDA a octroyé une autorisation tumeur agnostique pour le pembrolizumab en cas de tumeur solide présentant une TMB tissulaire supérieure à 10 mutations/Mb7. Le Dr Argilés souligne toutefois qu'aucun patient atteint d'un CCRm n'a participé à cette étude. Une étude de phase II (CCTG CO. 26), évaluant le durvalumab et le tremelimumab contre le meilleur traitement de soutien chez des patients atteints d'un CCRm, a montré que la TMB prédisait effectivement l'OS (en utilisant une autre valeur limite: TMB ? 28 mutations/Mb dans l'ADN circulant) 8. L'impact de la TMB sur l'OS des patients sous durvalumab et tremelimumab était toutefois minime. Le Dr Argilés estime dès lors que pour l'instant, dans le CCRm, la décision en faveur de l'immunothérapie ne peut pas être prise sur la base de la TMB. Les données d'une étude de phase II évaluant le pembrolizumab chez des patients présentant une mutation du domaine exonucléase de l'ADN polymérase E (POLE)9 ont également été présentées récemment. En cas de mutations pathogènes, l'ORR était de 50%, contre 0% en cas de mutations non pathogènes. Enfin, le Dr Argilés s'est intéressé à l'immunothérapie pour les tumeurs à microsatellites stables (MSS), caractérisées par un faible nombre de mutations et une immunogénicité faible. Des données prometteuses sont fournies par l'étude NICHE, qui a évalué le traitement néoadjuvant par ipilimumab + nivolumab à la fois chez des patients atteints d'un CCR dMMR et chez des patients atteints d'un CCR pMMR10. Les premières données montrent un pourcentage de réponse de 100% dans le groupe dMMR et de 25% dans le groupe pMMR (figure 1). Une infiltration plus élevée de la tumeur par des lymphocytes CD8+PD1+ a été relevée chez les répondeurs en comparaison aux non-répondeurs. Des études de suivi doivent à présent nous dire si cette infiltration peut être utilisée comme biomarqueur afin d'identifier les patients atteints d'un CCR MMS pouvant tirer profit d'une immunothérapie 11. De plus amples études sur les mécanismes biologiques impliqués dans le contournement du système immunitaire ouvriront probablement la voie à l'immunothérapie en cas de CCR MSS. Le Dr Argilés espère qu'à l'avenir, nous disposerons de traitements combinant immunothérapie et traitement ciblé, inhibant les facteurs responsables de la résistance du CCR.