Il y a une quarantaine d'années, les infections fongiques, virales et bactériennes posaient un problème majeur chez les patients à l'immunité fortement compromise. Depuis, divers développements ont permis de réduire le nombre d'infections, même si le chemin reste long.
Champignons
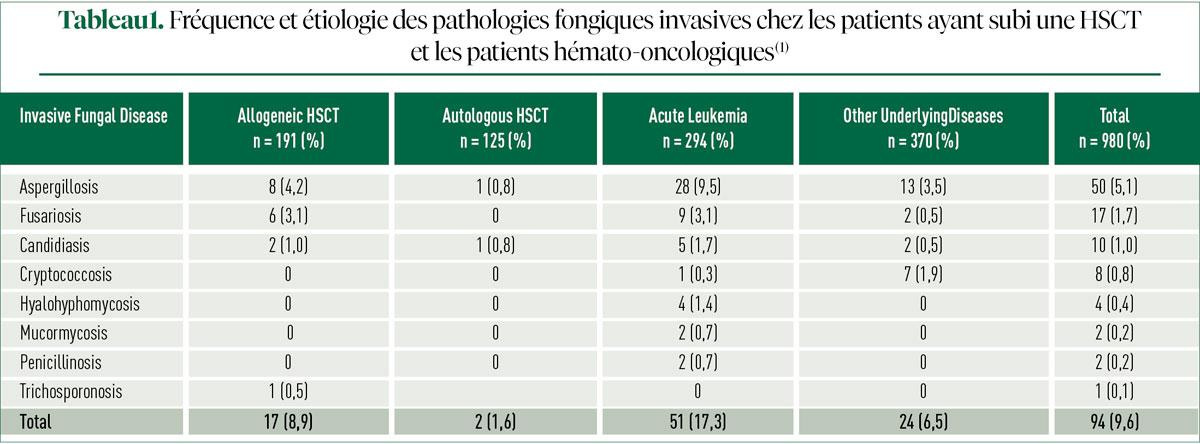
Une étude épidémiologique récente menée au Brésil révèle que près de 10% des patients les plus fortement immunocompromis (leucémie aiguë, autres hémopathies malignes, greffe de cellules souches hématopoïétiques allogéniques (allo-HSCT)) sont encore confrontés à une infection fongique invasive (Tableau 1)1. Des données rétrospectives belges montrent une aspergillose invasive avérée ou présumée chez des patients atteints d'une leucémie aiguë myéloblastique (AML) ou d'un syndrome myélodysplasique, après un traitement d'induction (9%) ou un traitement de consolidation (4%). L'incidence chez les patients ayant subi une allo-HSCT est de 4,7%. Lorsque l'aspergillose invasive "possible" est également prise en considération, les pourcentages sont multipliés par 2. Malgré leur diminution, les infections fongiques constituent donc encore un problème.
La survie globale des patients atteints d'une AML ou ayant subi une SCT myéloablative n'était pas plus mauvaise qu'après un traitement empirique.
- Stratégies
Au fil des ans, différentes stratégies ont été mises au point et testées chez des patients neutropéniques. Dans les années 1970-80, des antifongiques à large spectre étaient utilisés de manière empirique en cas de fièvre persistante (traitement basé sur la fièvre), lorsque le patient ne répondait pas aux antibiotiques à large spectre.
Les azoles sont ensuite apparus et des stratégies de prophylaxie primaire ont été élaborées. Dans les années 1990 et surtout 2000, le diagnostic (biomarqueurs, PCR et, plus tard, lateral flow devices) a été fortement privilégié. La surveillance et la détection précoce ont également fait l'objet d'une réflexion. Une stratégie appelée "traitement préemptif", combinant des biomarqueurs et des techniques radiologiques sensibles, a aussi été développée.
Après 2010, deux questions ont ainsi été posées:
- La prophylaxie primaire ou la surveillance (tests réguliers) est-elle préférable?
- Faut-il opter pour un traitement basé sur la fièvre ou pour un traitement préemptif?
Une étude randomisée de phase III de l'EORTC a récemment permis de répondre à cette dernière question. Les résultats ont été présentés l'année dernière lors de l'ICHS Symposium. Six semaines après une stratégie préemptive, la survie globale (OS) des patients atteints d'une AML ou ayant subi une SCT myéloablative n'était pas plus mauvaise qu'après un traitement empirique (respectivement 96,7% contre 93,1%). En outre, l'incidence des infections fongiques s'est avérée équivalente, bien que l'utilisation de médicaments antifongiques ait été réduite de moitié dans le bras préemptif. Dans cette étude, tous les patients ont reçu du fluconazole en prophylaxie contre les infections à Candida.
Actuellement, la première question ne connaît encore aucune réponse claire. La prophylaxie primaire se révèle efficace chez les patients hématologiques, mais s'accompagne de quelques inconvénients. Selon le Pr Maertens, il s'agit principalement des infections de percée et des interactions médicamenteuses.
Il ne fait aucun doute que les azoles ont changé la donne, mais entre-temps, le champ thérapeutique de l'hémato-oncologie a également évolué. Plus de 50% des nouvelles molécules thérapeutiques sont métabolisées via le cytochrome P450, notamment le CYP3A4, et possèdent un index thérapeutique étroit. Si ces small molecules (midostaurine, vénétoclax, ruxolitinib, ibrutinib...) sont associées à des inhibiteurs puissants du CYP3A4 (itraconazole, voriconazole, posaconazole...), il existe un risque d'aboutir tout à coup dans une plage toxique, avec pour conséquence une toxicité majeure imprévue. Nous nous trouvons donc face à un problème dans la prophylaxie primaire.
En outre, la prophylaxie s'accompagne aussi d'infections de percée. Celles-ci sont souvent mises en évidence uniquement par radiographie et concernent fréquemment un champignon résistant aux azoles ou un champignon non- Aspergillus, souvent intrinsèquement résistant à divers médicaments. Cette situation peut également être problématique, ainsi que le révèlent des études dans l'aspergillose invasive. L'OS à 6 semaines après un traitement par voriconazole a diminué de 70-80% à 40-50% en présence d'une infection à Aspergillus résistant aux azoles.
Heureusement, une amélioration s'annonce avec le développement de nouveaux antifongiques, notamment l'olorofirm, le fosmanogepix, la rézafungine et l'ibrexafungerp. Chacun de ces médicaments possède un mécanisme d'action différent mais est aussi actif contre Aspergillus résistant aux azoles.
Virus
Concernant les infections virales, le Pr Maertens a mis l'accent sur le cytomégalovirus (CMV), une cause majeure de décès dans les années 1970-80 (début de la médecine par SCT). Ici aussi, différentes stratégies ont été mises au point afin de mieux prendre en charge le CMV.
En raison de la myélotoxicité des médicaments utilisés, la prophylaxie antivirale n'est pas recommandée dans le contexte hématologique. En revanche, des tests sont régulièrement pratiqués afin de détecter l'ADN du CMV (PCR) et, s'ils sont positifs, un traitement antiviral préemptif est instauré. Le recours précoce à un traitement antiviral préemptif au cours des 10 à 20 dernières années a entraîné une forte diminution des pathologies à CMV.
En 2016, une étude rétrospective a toutefois montré que parallèlement à l'absence de maladie à CMV, la réplication du CMV après une HSCT a un impact négatif important sur l'OS, y compris la mortalité sans rechute2, surtout durant les 2 à 3 premiers mois après la greffe. Au cours des 10 dernières années, d'importants efforts ont donc été déployés afin de lutter contre la réplication du CMV.
- Lutte contre la réplication du CMV
Quelques possibilités ont été explorées. Plusieurs vaccins contre le CMV sont en cours de développement, mais la seule étude de phaseIII menée jusqu'à présent a produit des résultats négatifs. Une étude de phase II sur les anticorps monoclonaux s'est également révélée négative. En ce qui concerne les médicaments antiviraux, le célèbre aciclovir et le (val)ganciclovir (hautes doses) sont disponibles en Belgique, mais de nouveaux médicaments possédant un tout nouveau mécanisme d'action ont été développés au cours de la dernière décennie.
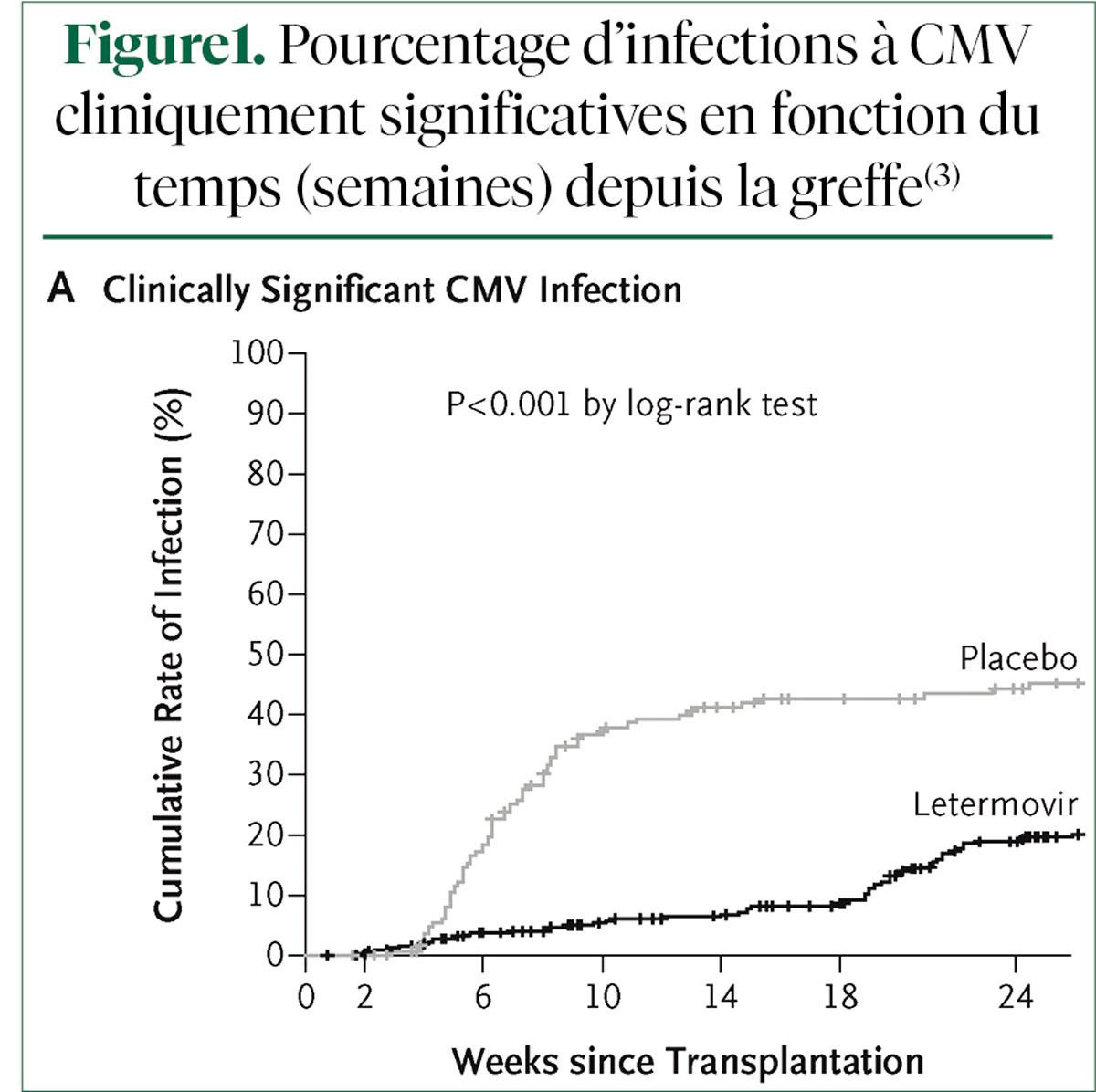
Une étude de phase III, randomisée, en double aveugle, a mis en évidence une réduction considérablement significative des réactivations du CMV chez les patients ayant subi une HSCT séropositifs au CMV (pas d'ADN du CMV lors de la randomisation) et ayant reçu du létermovir, un antiviral (action par inhibition du complexe terminase du CMV), pendant 14 semaines après la greffe, vs placebo (Figure1)3. Ce bras présentait également un avantage de survie à 24 semaines, bien que l'administration du létermovir ait été arrêtée à 14 semaines.
Récemment, une étude rétrospective de grande envergure a également permis d'observer une diminution du nombre de réactivations du CMV chez les patients ayant subi une allo-HSCT et reçu une prophylaxie primaire par létermovir, par rapport aux patients qui n'avaient jamais reçu le médicament4. En outre, une diminution significative de l'utilisation de médicaments antiviraux et des traitements antiviraux préemptifs a été observée dans le groupe traité par létermovir. Cette étude brise par ailleurs un paradigme historique. Alors que dans toutes les études publiées après 2004, une meilleure survie s'observait chez les receveurs séronégatifs au CMV par rapport aux receveurs séropositifs au CMV, cette étude montre que la prophylaxie primaire par létermovir efface la différence historique entre ces deux types de receveurs.
L'histoire ne s'arrête toutefois pas là. Dans la réalité, le létermovir est administré pendant 100jours, mais ensuite, des réactivations du CMV se manifestent à nouveau. De plus, il convient de tenir compte aussi des CMV résistants (génotypiques) et réfractaires (cliniquement résistants), qui impliquent une survie plus médiocre.
C'est dans ce dernier contexte que le nouveau médicament appelé maribavir vient d'être testé dans une étude de phaseIII5. Des patients greffés présentant un CMV résistant ou réfractaire ont été randomisés selon un rapport de 2: 1 pour recevoir soit du maribavir, soit un traitement au choix des investigateurs ((val)ganciclovir/foscarnet/cidofovir). Après 8semaines de traitement, 55,7% du bras maribavir étaient négatifs au CMV à la PCR, contre 23,9% dans l'autre groupe. Le profil de toxicité du maribavir était en outre nettement meilleur, avec la dysgueusie comme effet indésirable principal. Le nouveau médicament n'est pas encore disponible sur le marché, mais a été soumis pour approbation à la FDA et à l'EMA.
Bactéries
Un glissement de paradigme s'annonce aussi en ce qui concerne le traitement antibiotique chez les patients neutropéniques. Les recommandations standard préconisent de poursuivre l'antibiothérapie jusqu'à la récupération de la neutropénie, ce qui revient, en moyenne, à 12 à 16 jours d'antibiothérapie à large spectre. Une durée qu'il serait pourtant bénéfique de raccourcir: l'utilisation d'antibiotiques à large spectre pendant une longue durée est en effet le principal facteur de risque d'apparition d'infections à bactéries multirésistantes. En outre, ils peuvent provoquer des infections à Clostridiumdifficile et Candida spp. et entraîner une toxicité ainsi que des interactions pharmacologiques.
Des études prospectives randomisées n'ont pas encore permis de confirmer l'avantage et la sécurité de ce raccourcissement de la durée de l'antibiothérapie. En Belgique, une étude rétrospective a cependant été menée, dans laquelle l'effet d'une durée de traitement différente a été comparée lors d'une même stratégie dans deux hôpitaux6. Le méropénem a ainsi été dans les deux cas instauré le jour 1 de la neutropénie fébrile. À l'UZLeuven, il a été arrêté lors de la récupération de la neutropénie (après 19 jours en moyenne). En revanche, à l'Erasmus Medisch Centrum, à Rotterdam, le traitement a été arrêté après 3 jours si aucune infection cliniquement ou microbiologiquement documentée n'était observée (durée moyenne de 9 jours), indépendamment de la fièvre. Une antibiothérapie de durée réduite n'a pas donné lieu à une diminution du nombre de décès, ni du nombre d'admissions en soins intensifs et du nombre total de complications médicales sévères. Enfin, aucune différence significative n'a été mise en évidence en ce qui concerne la mortalité liée à l'infection.
L'étape suivante serait de comparer les deux possibilités thérapeutiques dans des études de plus grande ampleur. L'UZ Leuven, en collaboration avec l'UZ Gent, l'UZA, l'UZ Brussel et quelques plus petits hôpitaux, met d'ores et déjà sur pied une étude multicentrique destinée à cartographier l'effet d'une antibiothérapie de plus courte durée.
Références:
1. Bergamasco MD, et al. J Fungi 2021 ; 7: 588
2. Green L, et al. Lancet Hematol 2016 ; 3: e119-e127
3. Marty F, et al. NEJM 2017 ; 377: 2433-2444
4. Su Y, et al. Clin Infect Dis 2022 ; ciab1064. Doi: 10.1093/cid/ciab1064
5. Avery RK, et al. Clin Infect Dis 2021 ; ciab988. doi: 10.1093/cid/ciab988
6. Schauwvlieghe A, et al. eClinicalMedicine 2021 ; 35: 100855