La Pr Enriqueta Felip, cheffe de clinique du thorax, de la tête et du cou du département d'oncologie de l'hôpital Vall d'Hebron, à Barcelone, a présenté les résultats de cette étude portant sur le cancer du poumon non à petites cellules (NSCLC) de stade II-IIIA. L'atézolizumab (atézo) y a été comparé avec les meilleurs soins de soutien (BSC) dans le groupe de patients présentant une expression élevée de PD-L1.
Une sous analyse d'IMpower010
IMpower010 est la 1re étude de phase III portant sur une immunothérapie ayant mis en évidence une amélioration significative de la survie sans maladie (DFS) dans le contexte adjuvant après une chimiothérapie à base de platine. Lors d'une analyse intermédiaire, l'atézo a montré un avantage significatif en termes de DFS par rapport aux BSC chez les patients présentant une expression de PD-L1 dans plus de 1% des cellules tumorales (TC) (HR=0,66 ; IC à 95%: 0,50-0,88). La plus grande amélioration de la DFS était alors déjà observée dans la population TC PD-L1 >50%. Lors de l'ELCC, le Pr Felip a présenté une analyse plus approfondie de cette population atteinte d'un NSCLC de stade II-IIIA avec TC PD-L1≥50% (1).
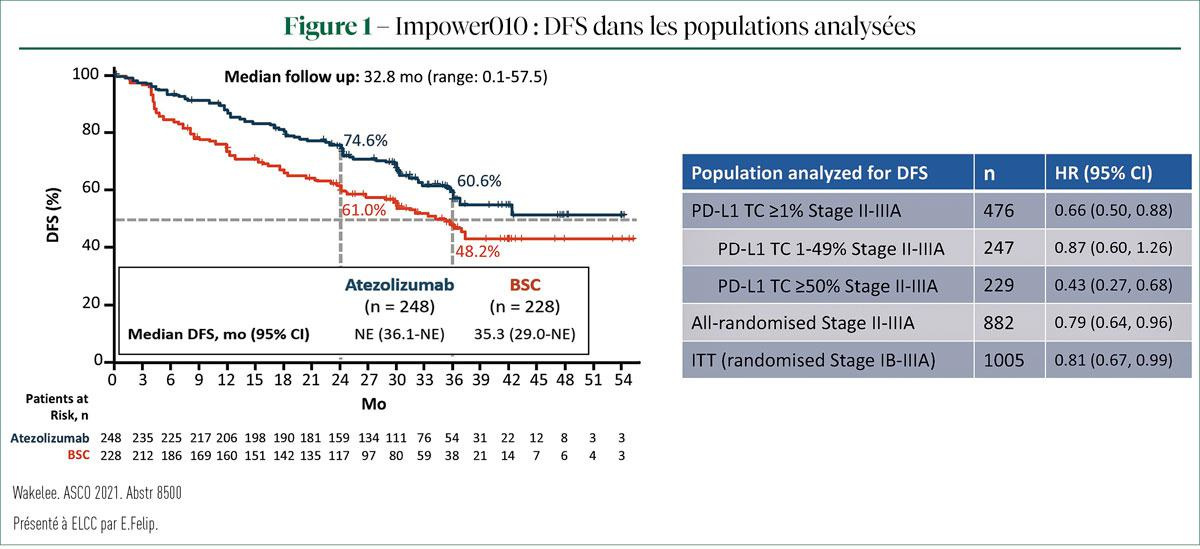
L'étude IMpower010 a inclus 1280 patients atteints d'un NSCLC de stade IB-IIIA, dont les tumeurs de stade IB devaient être > 4 cm. Tous les patients ont d'abord subi une lobectomie ou une pneumonectomie et reçu 1 à 4 cycles d'une chimiothérapie à base de cisplatine. 1005 patients ont ensuite été randomisés à 16cycles d'atézo (1200mg tous les 21 jours). Les critères d'évaluation principaux de l'étude étaient la DFS dans la population ITT (stade IB-IIIA) et chez tous les patients randomisés (stade II-IIIA), mais aussi parmi la population de stade II-IIIA avec TC PD-L1 >1%. Les critères d'évaluation secondaires étaient la survie globale (OS) dans la population ITT, la DFS dans la population de stade II-IIIA avec TC PD-L1≥50% et la DFS à 3 ans et à 5 ans dans les trois populations.
Cette sous-analyse a examiné la population de stade II-IIIA avec TC PD-L1 ≥50%, avec 115 patients dans le bras atézo contre 114 dans le bras BSC. Les caractéristiques des patients étaient quasi identiques dans les deux bras et largement comparables avec celles de la population ITT. La DFS médiane n'avait pas encore été atteinte dans le bras atézo, contre 35,7 mois dans le groupe BSC. Après 3 ans, la DFS atteint 73,8% dans le bras atézo, contre 48,6% dans le bras témoin. Une analyse plus approfondie n'a montré aucune différence notable dans les sous-groupes étudiés, y compris lorsque les patients présentant une mutation de l' EGFR/ALK+ ont été exclus de l'analyse. Les données relatives à l'OS dans cette population sont encore immatures, nécessitant un suivi plus poussé. Concernant le schéma des rechutes, nous remarquons que le pourcentage de rechutes locorégionales est pratiquement identique dans les deux bras (13% dans le bras atézo, 15% dans le bras BSC). Une rechute à distance est toutefois plus fréquente dans le bras BSC, par rapport aux patients qui ont reçu l'atézo (resp. 26 et 9%). Elle intervient après 18,1 mois dans le bras atézo, contre 10,1 mois dans le bras BSC.
L'aperçu de la sécurité de ce traitement dans la population de stade II-IIIA avec TC PD-L1 ≥50% est comparable avec celui de la population ITT. Le Pr Felip a souligné qu'aucun effet indésirable de grade V n'a été observé dans le bras atézo, dans lequel le traitement a toutefois dû être arrêté chez 19% des patients à la suite d'un effet indésirable.
Le Pr Felip a dès lors conclu que ces résultats sont une nouvelle confirmation de la balance bénéfice-risque positive d'un traitement adjuvant par atézolizumab chez les patients atteints d'un NSCLC de stadeII-IIA présentant une expression de PD-L1 de 50% (2).
Furmonertinib dans le NSCLC avec mutation de l'EGFR naïf de traitement
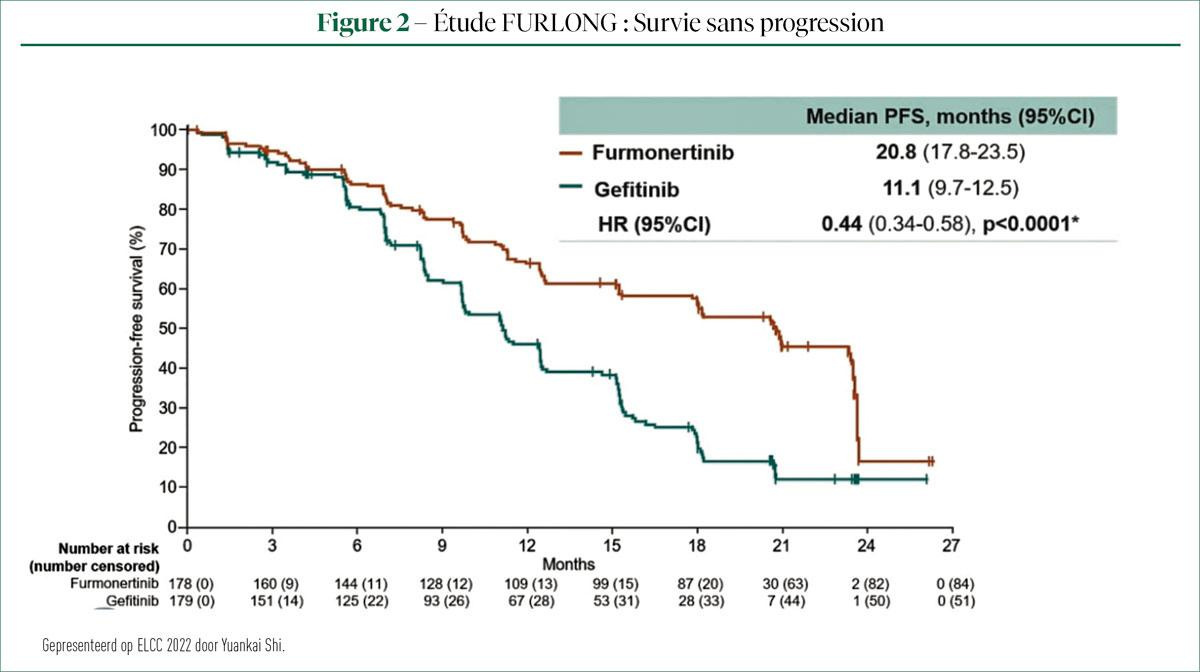
Le Pr Yuankai Shi (Pékin) a présenté les données de l'étude FURLONG de phase III, randomisée, en double aveugle, multicentrique, menée dans 55 hôpitaux chinois. Elle porte sur le furmonertinib (AST2818), un inhibiteur de tyrosine kinase (TKI) sélectif de 3e génération du récepteur du facteur de croissance épidermique (EGFR), capable d'inhiber de manière irréversible les mutations sensibilisantes de l'EGFR et les mutations résistantes du T790M (3). Cette étude a inclus 358 patients atteints d'un NSCLC localement avancé ou métastatique, avec mutation positive de l'EGFR et qui n'ont reçu aucun traitement antitumoral précédemment. Ces patients ont été randomisés au furmonertinib (FURMON) à 80mg par jour (QD) ou au géfitinib (GEF) à 250mg QD. Le traitement a été arrêté en cas de progression de la maladie, de toxicité intolérable ou d'instauration d'un nouveau traitement. Le critère d'évaluation principal de l'étude est la survie sans progression (PFS).
La PFS était nettement meilleure chez les patients traités par FURMON, par rapport au GEF. La PFS médiane dans le groupe FURMON était de 20,8mois, contre 11,1 pour les patients traités par GEF (HR=0,44, IC: 0,34-0,58 ; P<0,0001 ). (Figure 2) Une analyse par sous-groupe a montré un avantage systématique pour le FURMON par rapport au GEF dans tous les sous-groupes étudiés, y compris chez les patients présentant des métastases du SNC (HR=0,50, IC 0,32-0,80).
Le Pr Yuankai Shi a également abordé les critères d'évaluation secondaires de l'étude. Le taux de réponse objective (ORR= réponse complète (CR) + réponse partielle (PR)) et le taux de contrôle de la maladie (DCR= CR+ PR+ maladie stable (SD)) étaient pratiquement identiques avec le FURMON et avec le GEF: 89% dans le groupe FURMON, contre 84% dans le groupe GEF. Le DCR atteint, respectivement, 96% et 93%. La durée de la réponse, en revanche, montre à nouveau un avantage en faveur du FURMON, par rapport au GEF: 19,7mois contre 10,5mois (HR= 0,39, IC: 0,29-0,52). La durée jusqu'à la progression de la tumeur était également plus longue chez les patients ayant reçu le FURMON, par rapport aux patients ayant reçu le GEF (20,9mois contre 11,2 mois). L'OS médiane n'avait encore été atteinte dans aucun des deux groupes. Le Pr Yuankai Shi a souligné que dans le groupe ayant reçu le GEF comme premier traitement, 43% ont ensuite reçu un TKI de 3e génération de l'EGFR après la progression.
Lors de l'analyse des données de sécurité, il convient de tenir compte du fait que la durée médiane du traitement par FURMON est de 18,3 mois, contre 11,2 mois avec le GEF. 11% du groupe FURMON ont développé un effet indésirable lié au traitement de grade III ou supérieur, contre 18% du groupe GEF. Le traitement a dû être arrêté de manière temporaire chez 13% du groupe FURMON, contre 16% du groupe GEF. Le traitement a été arrêté de manière définitive chez 3%, contre 2%, respectivement.
Les effets indésirables les plus fréquents liés au traitement par FURMON sont une augmentation du taux d'ALAT (alanine aminotransférase) (28%), une diarrhée (25%), une augmentation du taux d'ASAT (aspartate aminotransférase) (25%) et une éruption cutanée (17%). Un patient dans chaque groupe a développé une pneumopathie interstitielle.
Le Pr Shi a conclu que dans cette étude FURLONG de phase III, randomisée, en double aveugle, le furmonertinib peut être associé à une PFS significativement plus longue que le géfitinib chez les patients atteints d'un NSCLC avec mutation de l' EGFR non traité. En outre, le furmonertinib présente un meilleur profil de sécurité que le géfitinib. Le furmonertinib peut dès lors être considéré comme le traitement de 1re ligne de prédilection chez les patients chinois atteints d'un NSCLC avec mutation de l'EGFR (4).
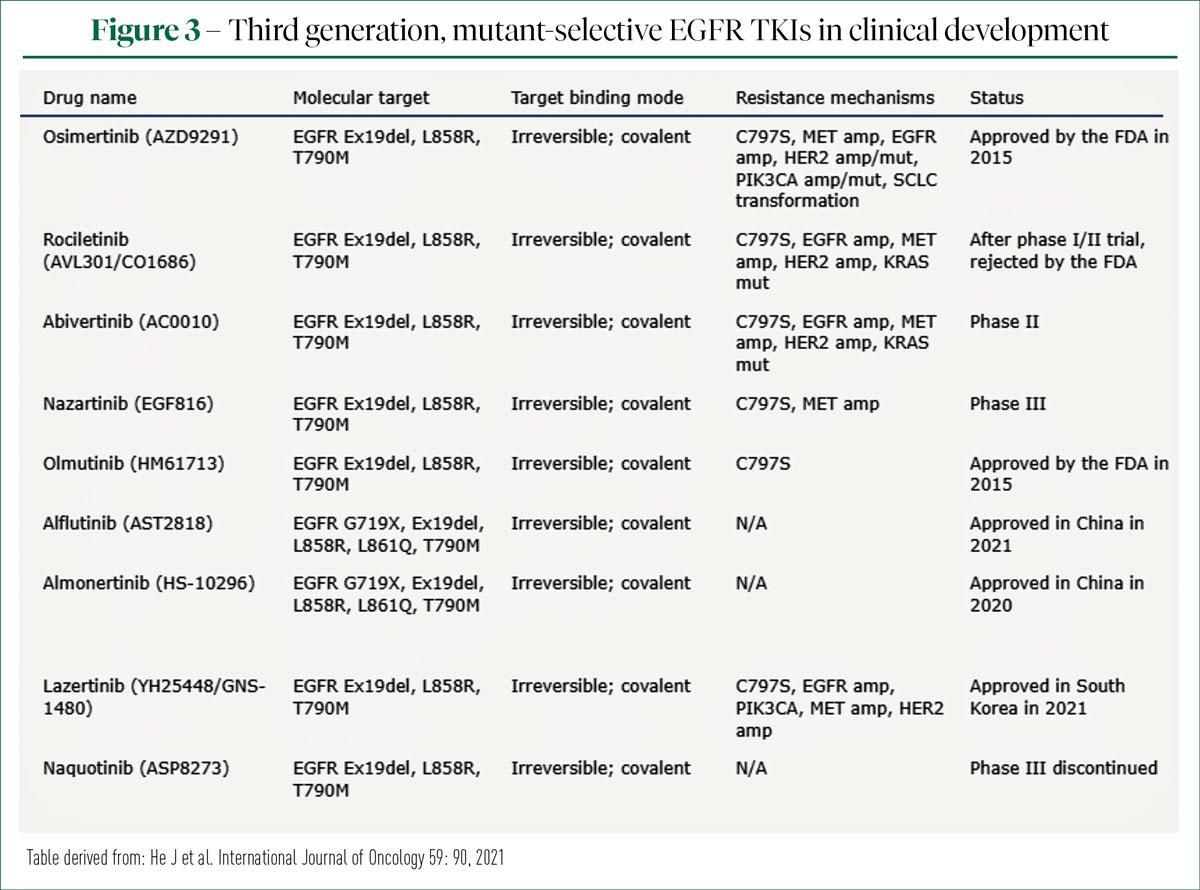
Dans son commentaire de cette étude, la Pr Christine Lovly, de la Vanderbilt University, à Nashville, s'est interrogée sur la place du furmonertinib dans le paysage actuel bien rempli des TKI de 3e génération de l'EGFR. De quelle manière ces inhibiteurs se différencient-ils entre eux? Qu'en est-il de la réponse intracrânienne? Ces molécules possèdent-elles un profil de sécurité différent? Le prix/remboursement va-t-il jouer un rôle crucial? Et qu'en est-il de la disponibilité de ces molécules dans différentes régions du monde? Le tableau1 présente une liste des TKI de l'EGFR actuellement connus en cours de développement clinique.
La Pr Lovly a dès lors déclaré que des stratégies sont nécessaires afin d'optimiser l'efficacité d'un traitement de 1re ligne par TKI de l'EGFR. Tout d'abord, la combinaison des traitements de 1re ligne. Diverses études de phase II et de phase III portant sur la combinaison d'un TKI de l'EGFR et d'un VEGF/VEGFR (erlotinib/bévacizumab et erlotinib/ramucirumab) ont mis en évidence un avantage en faveur de la combinaison en ce qui concerne la PFS. Cependant, un avantage en termes d'OS n'a été observé avec aucune de ces combinaisons. En outre, les résultats de nombreuses études portant sur la combinaison d'osimertinib (OSI) et de bévacizumab (BEV) sont contradictoires. Une étude de phase I à un bras portant sur cette combinaison a rapporté un ORR de 80%, avec une PFS médiane de 19 mois (5). Lors d'une étude de phase II randomisée ayant inclus des patients présentant une mutation T790M de l'EGFR, la combinaison OSI+ BEV n'a pas donné lieu à un allongement de la PFS ni de l'OS (6). Une autre étude de phase II randomisée menée chez des patients naïfs de traitement (n=122) n'a pas non plus montré d'amélioration de la PFS pour l'OSI+ BEV, contre l'OSI en monothérapie (7). La combinaison d'un TKI de l'EGFR avec une chimiothérapie a été ou est actuellement étudiée. L'étude NEJ009 a comparé le GEF avec une combinaison GEF + chimiothérapie contenant du platine. Tant l'ORR que la PFS et l'OS étaient supérieurs dans le bras dans lequel la chimiothérapie a été ajoutée: l'OS médiane s'élevait à 59,9mois dans le bras combiné, contre 38,8mois dans le bras recevant la monothérapie par GEF (8). En outre, les résultats de l'étude FLAURA2 nous en dira plus sur la combinaison d'OSI + chimiothérapie vs l'OSI en monothérapie chez les patients n'ayant jamais été traités précédemment. La combinaison d'un TKI de l'EGFR et d'un traitement "ciblé" doit également être mentionnée. L'étude MARIPOSA de phase III en cours compare l'amivantamab + lazertinib avec l'OSI dans le NSCLC avec mutation de l'EGFR localement avancé ou métastatique.
Une deuxième stratégie d'optimisation consiste à utiliser un traitement local de consolidation (LCT) en cas de maladie résiduelle minime (MRD). Une étude randomisée multicentrique a inclus des patients atteints d'un NSCLC de stade IV, présentant au moins 3 métastases et pas de progression pendant au moins 3 mois après un traitement systémique de 1re ligne. Les patients ont reçu un traitement d'entretien ou ont été observés (MT/O), par rapport à un traitement local de consolidation (chirurgie et/ou radiothérapie). L'étude a été arrêtée en raison d'un avantage de PFS significatif en faveur des patients du bras LCT (14,2 mois contre 4,4 mois pour le MT/O). Une nette différence de l'OS a également été observée en faveur du LCT (41,2 mois contre 17 mois) (9).
Selon la Pr Lovly, la troisième stratégie consisterait à réaliser une stratification génomique plus poussée lors du diagnostic. Actuellement, les décisions thérapeutiques reposent uniquement sur l'absence ou la présence de la mutation de l'EGFR (ex19del ou L858R). La question est de savoir s'il est possible d'approfondir afin d'utiliser plusieurs biomarqueurs lors de choix thérapeutiques en 1re ligne. La présence simultanée de la mutation TP53 a déjà été décrite comme un facteur pronostique négatif et est associée à une évolution plus défavorable. La présence d'une mutation RBM10 serait également un biomarqueur d'une mauvaise réponse au traitement par inhibiteur de l'EGFR. La Pr Lovly a fait remarquer à juste titre qu'après 20 ans d'expérience, nous traitions encore les mutations ex19del et L858R de la même manière, malgré les preuves suffisantes montrant que ces deux mutations ne sont pas identiques du point de vue biochimique. Ainsi, l'étude FLAURA a montré qu'il n'existait pas d'avantage en termes d'OS avec l'OSI dans la cohorte L858R, contrairement à la cohorte ex19del.
Une stratégie d'optimisation suivante consiste à utiliser des biomarqueurs dynamiques de la réponse afin de sélectionner les patients chez qui la dose d'un traitement peut être augmentée. La disparition de l'ADN tumoral circulant (ctDNA) pourrait être un tel biomarqueur dynamique et est déjà atteinte 3 à 6 semaines après le début du traitement. L'étude FLAURA a montré que la PFS chez les patients chez qui le ctDNA était encore présent après 3 semaines était nettement inférieure par rapport au groupe chez qui une disparition du ctDNA était observée (11,3 mois contre 19,8 mois). Dans d'autres études également, un ctDNA persistant a été associé à une durée de traitement plus courte et à une OS moindre.

La dernière stratégie mentionnée par la Pr Lovly est l'utilisation de méthodes alternatives pour cibler le récepteur de l'EGF muté. Elle pense ici aux inhibiteurs allostériques, aux conjugués anticorps-médicaments et aux PROTAC (chimères ciblant la protéolyse), aux vaccins et à l'utilisation de la thérapie cellulaire CAR-T. Bref, de nombreuses études restent nécessaires.
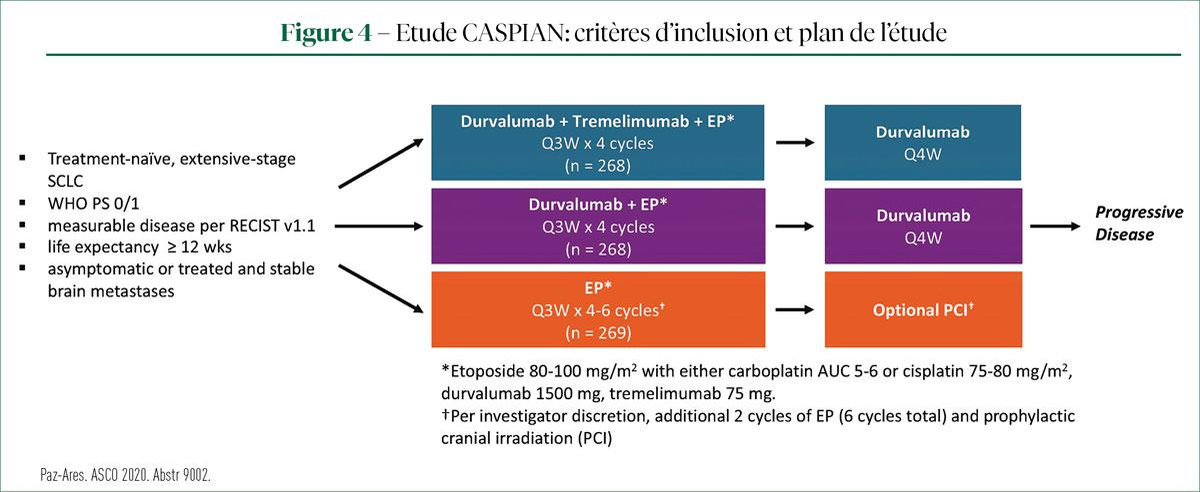
Les survivants à long terme dans l'étude CASPIAN
Le Pr Niels Reinmuth (Asklepios Longkliniek, Munich) a commenté les résultats d'une analyse post hoc des caractéristiques des survivants à long terme dans l'étude CASPIAN. Cette étude de phase III a été menée dans le traitement de 1re ligne du carcinome bronchique à petites cellules à un stade étendu (ES-SCLS). Les critères d'inclusion et le plan de l'étude sont décrits à la figure 3.
L'étude a rapporté un avantage de survie significatif pour le traitement de 1re ligne par durvalumab (DUR) en combinaison avec l'étoposide+ platine (EP), contre l'EP chez les patients atteints d'un ES-SCLC. L'avantage de survie s'est maintenu lors d'un suivi médian de plus de 3 ans (11). La combinaison DUR+ trémélimumab (TRE)+ EP a présenté une amélioration numérique de l'OS, par rapport à l'EP seul (12). Les biomarqueurs prédictifs de l'efficacité de l'inhibition des points de contrôle immunitaire ne sont pas encore réellement déterminés dans le traitement du SCLC.
Les survivants à long terme étaient définis sur le plan clinique comme les patients encore en vie au moment de la date limite de collecte des données (22 mars 2021). Tant dans le bras DUR+ EP que dans le bras DUR+ TRE+ EP, pratiquement 3 fois plus de patients étaient encore en vie à ce moment, après un suivi médian de 39,4mois, par rapport au bras EP (respectivement 16% pour DUR+ EP, 14% pour DUR+ TRE+ EP, 5% pour EP).
Bien que par rapport à la population ITT, le groupe LTS ait présenté une incidence supérieure de quelques caractéristiques pronostiques favorables au début du traitement, certains patients atteints de métastases cérébrales ou hépatiques ont atteint une survie plus longue. Les patients du groupe LTS avaient plus de chances d'achever l'induction par EP (4 cycles ou plus) et présentaient plus souvent une réponse objective et une PFS plus longue dans les bras DUR+ EP et DUR+ TRE+ EP, par rapport à la population ITT. Il convient de mentionner qu'à la date limite de collecte des données, 44 patients du groupe LTS ont poursuivi leur traitement par DUR.
Le report de la dose de durvalumab était davantage nécessaire chez les patients du groupe LTS que dans la population ITT. Malgré une exposition plus longue, les patients du groupe LTS n'ont pas connu d'augmentation des effets indésirables graves, par rapport à la population ITT. La distribution de ces effets indésirables graves par système/classe d'organes était comparable dans le groupe LTS et la population ITT.
Aux points d'orientation de 18 et 36 mois de l'OS, l'expression de PD-L1, la tTMB ( tissue tumour mutational burden) et la présence ou l'absence de l'allèle HLA-DQB1*03: 01 comme biomarqueurs ont été analysés. Dans le bras DUR+ EP, aucune association entre la présence de l'expression de PD-L1, de la tTMB ou de la HLA-DQB1*03: 01 et une OS >18mois ou >36mois n'a été observée. Dans le bras DUR+ TRE+ EP, l'expression de PD-L1 (TC ou CI ≥1%) et la présence de HLA-DQB1*03: 01 étaient supérieures chez les patients avec une OS >18mois. Elles se maintenaient à une OS >36mois, mais sur la base de plus petits nombres de patients. Le Pr Reinmuth a conclu que de plus amples études sont nécessaires afin de mieux comprendre le rôle possible de ces biomarqueurs et d'autres dans le SCLC (13).
Références:
1. Felip E, et al. Lancet 2021 ; 398: 1344-57
2. Felip E, presentation at ELCC 2022, Proferred Paper Session, # 800
3. Xingsheng Hu, et al. JCO 2021, Meeting Abstract ASCO 2021
4. Yuankai Shi, Presentation at ELCC 2022, Proferred Paper Session, # 10
5. Yu H, et al. JAMA Oncology 2020
6. Akamatsu H, et al. JAMA Oncology 2021
7. Kenmotsu H, et al. ESMO 2021 LBA44)
8. Hosomi et al. JCO 2020
9. Gomez et al. JCO 2019
10. Ramalingam et al. NEJM 2020
11. Paz-Ares L, et al. Lancet 2019 ; 394: 1929- 39
12. Goldman JW, et al. Lancet Oncol 2021 ; 22: 51 -65
13. Reinmuth N, presentation at ELCC 2022, Proferred Paper Session, # 1410