L'intensification du traitement est désormais la nouvelle norme de soins chez les patients atteints d'un cancer de la prostate à haut risque.
Au-delà de l'étude STAMPEDE
- Association de traitements systémiques
Le Pr Gerhardt Attard (UCL Cancer Institute, Royaume-Uni) commente une méta-analyse de deux études randomisées de phase III menées selon le protocole STAMPEDE (1). L'étude incluait des patients atteints de PCa à haut risque sans métastases (M0) à la tomographie conventionnelle et à la scintigraphie osseuse. Les patients nouvellement diagnostiqués et les patients présentant une récidive après une prostatectomie radicale (RP) ou une radiothérapie (RT) ont été inclus selon les critères mentionnés à la figure 1.
Cette analyse a porté sur 1974 patients, traités par une thérapie de privation androgénique (ADT) (norme de soins, SOC), ou par le SOC + abiratérone (ABI), avec ou sans enzalutamide (ENZA). L'âge médian était de 68 ans et le PSA médian était de 34ng/ml. Seuls 3% des patients ont présenté une récidive après un traitement antérieur. Au total, 39% des patients avaient des ganglions positifs (N1). La RT était obligatoire pour les patients nouvellement diagnostiqués sans ganglions positifs (N0) (99%), et recommandée pour les patients ayant un PCaN1 (71%). Le suivi médian de la population étudiée s'élevait à 72 mois. Le suivi a été plus long dans le groupe ABI (85mois) que dans le groupe ABI + ENZA (60mois).
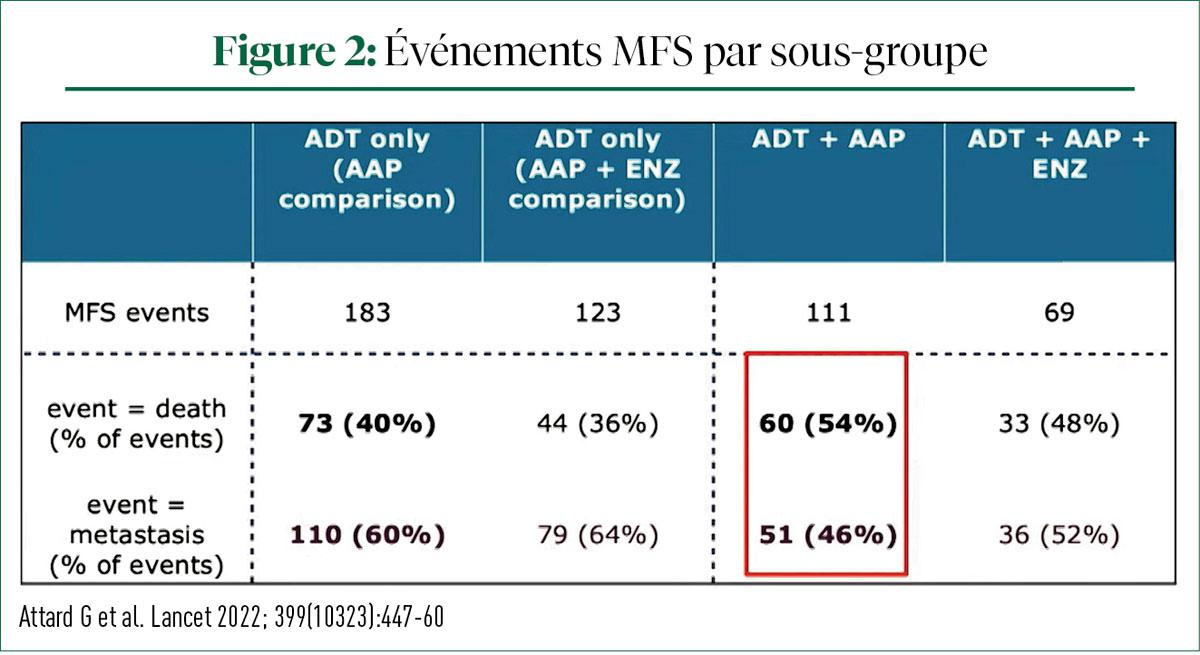
Après un suivi de 6 ans, 180 cas de survie sans métastases (MFS) ont été recensés dans le groupe combiné, contre 306 dans le groupe témoin. La MFS était de 82% dans le groupe SOC + ABI et de 69% dans le groupe SOC. La survie globale (OS) (HR 0,60, IC à 95%0,48-0,73, p<0,0001), la survie spécifique au PCa (0,49, IC à 95%0,37-0,65, p<0-0001) et la survie sans progression (PFS) (HR 0,44, 0,36-0,54, p<0-0001) étaient significativement plus longues dans le groupe du traitement combiné que dans le groupe SOC. L'analyse de la MFS en fonction de la période de randomisation (SOC + ABI vs SOC + ABI + ENZA) n'a montré aucune différence en termes de MFS (interaction HR 1,02 ; 0,70-1,50, p=0,91) (Figure 2). Cela suggère que l'ajout de l'ENZA au schéma ABI + SOC n'améliore pas la MFS à long terme chez les hommes présentant un PCaM0 à haut risque.

Le Pr Attard souligne que les patients avec récidive étaient sous-représentés dans l'analyse et que des études supplémentaires sont nécessaires pour s'assurer de l'efficacité éventuelle de l'ajout d'ABI dans cette population. Par ailleurs, il considère que le manque d'informations sur les complications après 2 ans constitue une limitation de cette analyse. Néanmoins, il conclut que l'administration d'ABI pendant 2 ans + RT + 3 ans d'ADT devrait devenir un nouveau traitement de référence pour le PCaM0 à haut risque (classification STAMPEDE).
Traitement de la tumeur primitive
- Radiothérapie
Le Pr David Dearnaley (Institute of Cancer Research, Royaume-Uni) précise que le terme "PCa à haut risque" prête à confusion, car des organisations telles que le NCCN, l'EAU et le NICE utilisent des définitions différentes. Il conseille donc, lors de l'interprétation des résultats de l'étude, de vérifier quel type de PCa à haut risque a été traité. Les patients de l'étude STAMPEDE se rapprochaient de la classification du PCa à haut risque de NICE, mais leur taux de PSA était ≥40 et non ≥ 20ng/ml.
Le Pr Dearnaley a discuté des résultats d'une méta-analyse (HEAT) qui compare les bénéfices relatifs de la RT avec escalade de dose ± une ADT de courte durée (STADT) ou une ADT de longue durée (LTADT) chez les patients atteints de PCa localisé (2). Les données individuelles obtenues auprès de 11.862 patients issus de 13 essais randomisés pertinents ont été analysées. Les patients ont reçu l'un des 6 traitements suivants: RT à faible dose (64 à <74Gy) ± STADT ou LTADT, RT à forte dose (≥74Gy) ou RT à forte dose ± STADT ou LTADT. La MFS était le critère d'évaluation principal. Le suivi médian était de 8,8 ans. La plus grande amélioration relative sur le plan de la MFS et de l'OS a été observée pour le schéma avec ajout du LTADT, suivi du schéma avec ajout du STADT, indépendamment de la dose de RT administrée.
Bien que l'augmentation de la dose de RT n'ait pas conduit à une amélioration de la MFS ou de l'OS, elle a amélioré la survie sans récidive biochimique (BCRFS), ce qui est positif pour les patients, déclare le Pr Dearnaley. Les auteurs de cette étude ont conclu que le traitement combiné à base d'ADT et de RT à forte dose représente la meilleure stratégie thérapeutique, à condition que la RT ne provoque pas d'effets secondaires (AE) graves et n'altère pas la qualité de vie du patient.
Il est possible de réduire les AE de la RT, mais pour ce faire, nous devons utiliser tous les outils disponibles, déclare le Pr Dearnaley. Dans le cadre de l'étude CHHiP, une analyse prospective de 12 symptômes intestinaux signalés par le médecin ou le patient a conduit à un nouvel ensemble de limitations de la dose anorectale pour les schémas hypofractionnés jusqu'à 60Gy ou 57Gy (3). Ces limitations doivent être appliquées pour réduire les AE, souligne le PR Dearnaley. L'hypofractionnement modéré est désormais l'approche standard, toutefois l'hypofractionnement extrême - qui vise à réduire encore davantage le nombre de fractions - se révèle prometteur. L'étude Hermes (Hypofractionated Expedited Radiotherapy for Men With localisEd proState Cancer), en cours, compare 5 fractions de radiothérapie stéréotaxique extracrânienne (SBRT) à 2 fractions (4).

L'optimisation du volume cible est une autre stratégie pour améliorer l'effet de la RT. Un essai international randomisé de phase III a montré que l'extension de la RT de sauvetage aux ganglions lymphatiques pelviens + une courte période d'ADT réduit significativement la progression après une RP chez les patients atteints d'un PCa (5). L'impact de l'irradiation des ganglions lymphatiques est légèrement supérieur à l'effet obtenu après 6 mois d'ADT. Selon le Pr Dearnaley, l'irradiation des ganglions lymphatiques va devenir l'approche de référence.
L'administration d'une dose de rayonnement hétérogène avec un boost de dose sur la lésion dominante, qui peut être identifiée par IRM, est également une stratégie pour améliorer l'efficacité et réduire les AE, comme l'a démontré l'étude DELINEATE, explique le Pr Dearnaley (6).
Il conclut son exposé en jetant un regard vers l'avenir (figure 3). Selon lui, l'hypofractionnement extrême, l'irradiation des ganglions lymphatiques, les doses boost de RT ciblant les lésions dominantes et l'amélioration des technologies contribueront à l'intensification locale de la RT. Toutefois, il souligne que tous les patients ne sont pas éligibles à la RT et qu'une bonne coopération avec les chirurgiens est indispensable.
- Prostatectomie radicale
Le Pr Steven Joniau (UZ Leuven) aborde le rôle de la chirurgie chez les patients présentant un PCa à très haut risque, en commençant par un aperçu des données relatives au PCa en Belgique. Le cancer de la prostate est le cancer le plus fréquent chez l'homme: plus de 10.000 nouveaux cas diagnostiqués chaque année. Il est également la 2e cause de décès par cancer en Belgique, avec environ 1600 décès par an. Le Pr Joniau souligne l'importance d'avoir recours à la chirurgie chez les patients qui en ont le plus besoin.
Avec l'utilisation de nouvelles techniques d'imagerie telles que la TEP/TDM au PSMA, de nombreux patients sont diagnostiqués avec des métastases. Selon le Pr Joniau, il ne serait pas correct d'exclure la chirurgie comme option thérapeutique pour ces patients. Un sous-groupe de patients se situe entre le PCa localisé et les polymétastases, car les métastases peuvent être identifiées à un stade plus précoce ; il existe une distorsion du délai de mise en oeuvre du traitement.
La localisation des métastases détermine le pronostic des patients (7). Les patients avec des métastases au niveau des ganglions lymphatiques doivent être évalués différemment des patients présentant des métastases osseuses ou viscérales, a souligné le Pr Joniau. L'analyse de la base de données SEER suggère que les patients souffrant d'un PCa avec des métastases au niveau des os et/ou des poumons bénéficient d'une meilleure survie que ceux avec d'autres métastases viscérales (8). Les patients atteints d'un PCa métastatique de novo ont un pronostic plus défavorable que les patients qui rechutent après un traitement local (9).
L'étude STAMPEDE a montré que les patients présentant un nombre limité de métastases osseuses (≤3) peuvent tirer un bénéfice d'un traitement local (10). Malheureusement, selon le Pr Joniau, il n'existe pas encore de preuves robustes en faveur de la prostatectomie cytoréductrice chez les patients présentant des oligométastases. Sur la base de données prospectives appariées, le groupe du Dr Steuber a analysé l'impact de la RP chez les patients atteints d'un PCa avec ≤3 métastases osseuses ; il n'a cependant pas pu démontrer un bénéfice significatif en termes de survie (11).
L'essai de phase II TROMBONe, mené chez des hommes atteints de PCa oligométastatique de novo, est la 1re étude à examiner la possibilité de randomiser des patients pour recevoir une RP + une lymphadénectomie pelvienne + le SOC (12). Dans cette population de patients, le taux de complications était comparable à celui observé avec la RP dans les cas moins avancés. La qualité de vie des patients était également comparable. Un vaste essai randomisé est désormais nécessaire pour évaluer l'effet de la RP dans la prise en charge multimodale du PCa oligométastatique, conclut le Pr Joniau.
Trithérapie dans le cancer de la prostate métastatique: revue critique
Le Pr Fizazi (Gustave Roussy, France) a présenté les résultats de l'étudede phase III PEACE-1. Elle recourt à un plan factoriel 2 x 2 évaluant l'ABI + prednisone (PREDNI) et/ou la RT locale chez les hommes atteints d'un PCa métastatique de novo sensible à la castration (mCSPC) (13). Au total, 1173 patients ont été randomisés. En raison de l'évolution rapide du SOC dans cette indication, 710 participants ont reçu du docétaxel (DOCE) + ADT en tant que SOC, ce qui a permis d'évaluer la trithérapie (ABI + DOCE+ ADT), explique le Pr Fizazi.
La durée médiane d'OS n'a pas été atteinte avec la trithérapie, par rapport à une OS médiane de 4,4 ans dans le groupe de patients recevant uniquement DOCE + ADT (± RT). L'ajout de l'ABI a induit une réduction de 25% du risque de décès. Le Pr Fizazi souligne que le bénéfice en termes de survie associé à l'ABI a été observé malgré le fait que 84% des patients du groupe témoin avaient reçu un traitement ultérieur prolongeant la vie.
Ainsi, l'étude PEACE 1 peut être considérée comme la 1re étude comparant un traitement systémique précoce vs tardif, indiquant qu'une prise en charge précoce par un traitement systémique obtient de meilleurs résultats, déclare le Pr Fizazi.
Les résultats étaient encore meilleurs chez les patients présentant une maladie de haut volume (selon la définition CHAARTED): l'OS médiane, avec et sans ABI, s'élevait à 5,1 et 3,5 ans, respectivement, et le risque de décès présentait une réduction significative de 28%. Les AE étaient conformes aux attentes et comparables entre les deux groupes. Des différences n'ont été observées que pour l'hypertension et l'élévation des transaminases, à savoir 22% vs 13% et 6% vs 1%, respectivement. Le Pr Fizazi a souligné qu'en 10 ans, nous avons réussi à augmenter l'espérance de vie de ces patients de moins de 3 ans (ADT uniquement) à plus de 5 ans avec la trithérapie ADT + DOCE+ ABI.
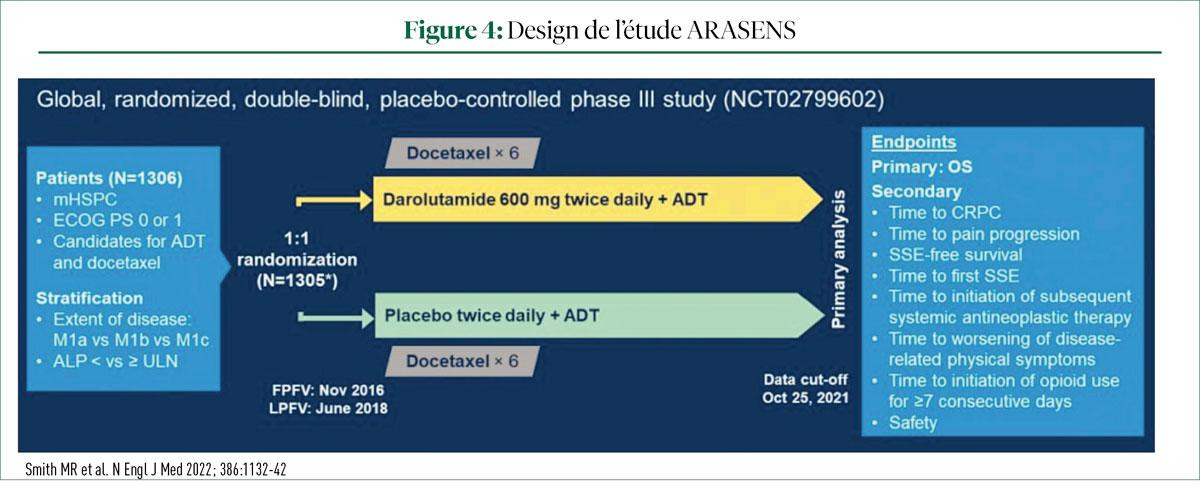
L'étude internationale de phase III ARASENS a démontré un bénéfice en termes de survie grâce à l'ajout du darolutamide (DARO) à l'ADT et au DOCE chez les patients atteints de mCSPC (14). La trithérapie DARO + ADT + DOCE a réduit le risque de décès de 32,5%, sans augmenter la toxicité.
Il est intéressant d'avoir deux études dont les résultats vont dans le même sens, a déclaré le Pr Fizazi. Sur la base de ces résultats, il conclut que la trithérapie (ADT + DOCE + ABI ou DARO si approuvé dans cette indication) représente la nouvelle norme de soins pour les hommes atteints de mCSPC de novo de volume élevé.
Au cours de la discussion, des réserves ont été formulées quant à la nécessité de considérer réellement la trithérapie comme une norme de soins chez les patients souffrant d'un mCSPC à haut risque. L'étudePEACE-1 montre que l'ajout de l'ABI à l'ADT + DOCE est plus efficace, mais il n'existe pas de données comparant la trithérapie à l'ABI + ADT. Le Dr Van Wambeke indique qu'il n'existe actuellement aucune preuve de niveau 1 pour recommander la trithérapie, mais qu'il peut s'agir d'une approche pragmatique car les patients présentent encore une condition physique suffisante pour recevoir du DOCE au début du cycle de traitement.
Le groupe témoin dans les études sur le mCRPC: meilleure norme de soins ou norme de soins minimale?
La dernière présentation de la réunion, réalisée par le Dr Simon Van Wambeke (ZNA Jan Palfijn), a fait figure de révélation pour les médecins présents. Il a analysé le bras témoin des études cliniques d'enregistrement: dans un grand nombre d'études, un bras témoin sous-optimal est utilisé pour démontrer la supériorité du traitement actif (15). Bien que dans certains cas, le recrutement est déjà achevé au moment où un nouveau SOC est établi, certaines études qui ont démarré après continuent à utiliser comme bras témoin le SOC sous-optimal déjà prouvé. Le Dr Van Wambeke déplore que peu d'études reconnaissent ce facteur comme étant une limitation majeure lors de la discussion des résultats.

Le Dr Van Wambeke évoque l'étude PROFOUND, qui évaluait l'olaparib (OLA) chez des patients atteints de mCRPC avec mutations génétiques après progression sous traitement par ENZA ou ABI (ARTA). Pour les patients du groupe SOC, le médecin pouvait choisir un traitement. Or, selon le Dr Van Wambeke, il ne s'agissait pas réellement d'un choix car il ne pouvait administrer que des ARTA, c'est-à-dire des traitements sous lesquels les patients avaient déjà progressé avant le début de l'étude. De plus, près de 20% des patients avaient déjà été traités par les deux ARTA, malgré la preuve de l'inefficacité de cette approche. 35% des patients n'avaient pas encore reçu de DOCE, et 45% des patients prétraités par DOCE n'avaient pas encore reçu de cabazitaxel (CABA), alors qu'il a été démontré que ces traitements améliorent la survie dans l'indication mCRPC.
Dans la cohorte A de l'étude PROFOUND, un bénéfice en termes de survie a été démontré pour l'OLA, mais, selon le Dr Van Wambeke, nous ignorons quel aurait été le résultat si le médecin avait véritablement pu choisir le traitement dans le groupe témoin. Toujours dans l'étude VISION, le groupe témoin a reçu un ARTA après un ARTA. Les résultats du groupe témoin de la cohorte A de l'étude PROFOUND mettent en évidence le bénéfice limité de l'administration d'un ARTA après un traitement par ARTA (PFS médiane: 3,6 mois, réponse PSA50: 8%, réponse totale: 2%). Selon le Dr Van Wambeke, il est possible de mettre en place un meilleur groupe témoin, comme l'a démontré l'étude CARD, dans laquelle du CABA a été administré après progression sous DOCE (PFS médiane: 8 mois, réponse PSA50: 37,5%, réponse totale: 37%). Il reconnaît qu'il est parfois difficile d'assigner de façon aléatoire des patients à une CT intraveineuse par rapport à un traitement oral, mais l'étude CARD prouve que c'est faisable. Selon lui, l'utilisation d'un ARTA après un ARTA dans le bras témoin ne représente une option que pour les patients présentant des contre-indications clairement spécifiées à la CT ou dans le cadre d'études de preuve de concept.
La non-utilisation du meilleur SOC dans le groupe témoin dans les essais cliniques entraîne un sous-traitement pour des patients disposés à participer à des études dans l'intérêt de futurs patients. Plusieurs études sont aujourd'hui en cours avec un groupe témoin ARTA-ARTA. Le Dr Van Wambeke préconise que les études en phase initiale de recrutement adaptent leur groupe témoin afin d'intégrer une meilleure stratégie thérapeutique et éventuellement aussi afin d'obtenir des résultats plus informatifs pour la pratique clinique.
Le Dr Van Wambeke fait référence à un article du Dr Darrow (Indiana Law Review 2014), qui met en évidence le nombre excessif de parties prenantes dans le processus d'approbation d'études et de traitements sous-optimaux, ce qui rend les responsabilités difficiles à établir. Il indique qu'il est nécessaire de discuter de ce point avec le patient et, en tant que médecins, de ne pas participer à des études qui sont dotées d'un groupe témoin sous-optimal. Nous devons exiger la mise en place du meilleur groupe témoin possible si nous acceptons de participer à des essais cliniques.
Au cours du débat, il est également avancé qu'il est ardu d'obtenir un financement pour une étude portant sur des traitements non systémiques, de sorte que les bénéfices éventuels pour le patient ne peuvent pas être démontrés. De ce point de vue, il est intéressant de constater que des efforts sont actuellement consentis au niveau européen pour conclure un accord avec l'industrie pharmaceutique, qui permettra de libérer des budgets pour des études universitaires dotées de leurs propres méthodologies.
Références:
1. Attard G et al. Lancet2022 ; 399(10323): 447-60
2. Kishan AU et al. Eur Urol2022 ; 82(1): 106-114
3. Wilkins A et al. Int J Rad Oncol 2020 ; 106(5): 928-38
4. Westley R et al. Clin Oncol2022 ; 34(7): 426-29
5. Pollack A et al. Lancet Oncol 2022 ; 399(10338): 1886-1901
6. Murray JR et al. Int J Radiat Oncol Biol Phys 2020 ; 106(4): 715-24
7. Bernstein AN et al. J Urol. 2018 ; 199(6): 1510- 17
8. Budnik J et al. Clin Genitourin Cancer2019 ; 17(4): 260-7
9. Kyrikopoulos CE et al. J Clin Oncol2018 ; 36(11): 1080-87
10. Adnan A et al. JAMA Oncol 2021 ; 7(4): 555-63
11. Steuber S et al. Eur Urol Focus 2017 ; 3(6): 646-49)
12. Sooriakumaran P et al. BJU Int2021
13. Fizazi K et al. Lancet 2022 ; 399(10336): 1695-1707
14. Smith MR et al. N Engl J Med 2022 ; 386: 1132-42
15. Van Wambeke S et al. J Clin Oncol2022 ; 40(14): 1518-21