...
La thérapie génique pour retrouver la vue et restaurer l'audition
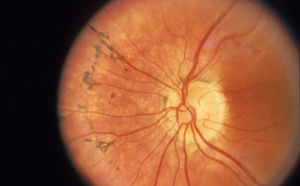
La thérapie génique pourrait un jour redonner la vue aux personnes malvoyantes et l'ouïe à celles qui sont sourdes. Trois études récentes entretiennent cet espoir.
Vous souhaitez continuer à nous lire?
Inscrivez-vous pour avoir accès au contenu de ce site.* Et en plus, lisez 4 articles gratuits chaque mois
Je m'enregistre Je suis déjà enregistré* Le journal du Médecin, Belgian Oncology & Hematology News, jm update Spécialiste sont des magazines médicaux. La Loi belge stipule que seuls les médecins et prestataires de soins avec un numéro Inami peuvent le consulter. Ceci vaut aussi pour ce site.
Accès illimité à tous les articles pour les membres du Club du journal du Médecin
Je deviens membre Je suis membreVous souhaitez continuer à nous lire?
Inscrivez-vous pour avoir accès au contenu de ce site.* Et en plus, lisez 4 articles gratuits chaque mois
Je m'enregistre Je suis déjà enregistré* Le journal du Médecin, Belgian Oncology & Hematology News, jm update Spécialiste sont des magazines médicaux. La Loi belge stipule que seuls les médecins et prestataires de soins avec un numéro Inami peuvent le consulter. Ceci vaut aussi pour ce site.
Accès illimité à tous les articles pour les membres du Club du journal du Médecin
Je deviens membre Je suis membre